
分析 (1)利用蓋斯定律計算反應熱,得到平衡狀態時,正逆反應速率相等,各物質的濃度不變,由此衍生的一些物理量也不變,計算平衡時各物質的濃度,可K=$\frac{c(S{O}_{3})c(NO)}{c(N{O}_{2})c(S{O}_{2})}$計算平衡常數;
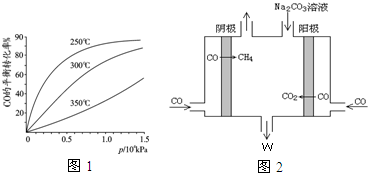
(2)①圖象分析可知壓強一定,溫度升高CO轉化率減小,說明升溫平衡逆向進行,逆向是吸熱反應,溫度在250°一氧化碳轉化率高,反應速率大,既能加快反應速率,又能使平衡混合物中CH3OH物質的量分數增大,依據影響化學反應速率的因素分析,反應正向進行,
CO(g)+2H2(g)═CH3OH(g),反應是氣體體積減小的放熱反應,
a. 反應是放熱反應,升溫速率增大,平衡逆向進行;
b.恒容條件下充入H2 ,增大反應物濃度平衡正向進行,反應速率增大;
c.催化劑改變反應速率不改變化學平衡;
d.恒容條件下再充入1molCO,2mol H2 ,相當于增大壓強平衡正向進行;
e.壓縮體積壓強增大反應速率增大平衡正向進行;
f.移走一部分CH3OH平衡正向進行,反應速率減小;
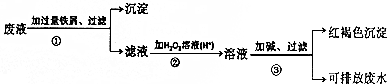
②由此電解原理可知,陽極失去電子生成二氧化碳氣體,加入碳酸鈉,碳酸鈉與二氧化碳反應生成碳酸氫鈉,陰極CO得到電子生成甲烷氣體,據此解答即可;
解答 解:(1)①NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-56.5kJ•mol-1
②2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1
將方程式(②-①×2)×$\frac{1}{2}$得:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ/mol,
a.隨反應:NO2(g)+SO2(g)?SO3(g)+NO(g)的進行,氣體的質量和物質的量都不變,混合氣體的平均相對分子質量始終不變,不能說明到達平衡狀態,故a錯誤;
b.混合氣體顏色保持不變,說明二氧化氮的濃度不變,說明到達平衡狀態,故b正確;
c.隨反應進行,SO3和NO都是生成物,所以體積比一直等于系數比,所以SO3和NO的體積比保持不變,不能說明到達平衡狀態,故c錯誤;
d.每生成1molSO3的同時消耗1molNO2都表示逆反應速率,反應自始至終都按此比例進行,故d錯誤;
一定條件下,將NO2與SO2以體積比1:2設為a和2a,消耗二氧化氮為x,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物質的體積 a 2a 0 0
轉化物質的體積 x x x x
平衡物質的體積 a-x 2a-x x x
平衡時NO2與SO2體積比為1:3,即(a-x):(2a-x)=1:3,
故x=0.5a,故平衡常數K=$\frac{c(S{O}_{3})c(NO)}{c(N{O}_{2})c(S{O}_{2})}$=$\frac{0.5a×0.5a}{(a-x)(2a-x)}$=$\frac{0.5a×0.5a}{0.5a×1.5a}$=$\frac{1}{3}$,
故答案為:-41.8;b;$\frac{1}{3}$;
(2)①圖象分析可知壓強一定,溫度升高CO轉化率減小,說明升溫平衡逆向進行,逆向是吸熱反應,正向為放熱反應,△H<0,圖象分析可知,溫度在250°一氧化碳轉化率高,反應速率大,既能加快反應速率,又能使平衡混合物中CH3OH物質的量分數增大,依據影響化學反應速率的因素分析,反應正向進行,
CO(g)+2H2(g)═CH3OH(g),反應是氣體體積減小的放熱反應,
a. 反應是放熱反應,升溫反應速率增大,但平衡逆向進行,故a錯誤;
b.恒容條件下充入H2 ,增大反應物濃度平衡正向進行,反應速率增大,CH3OH物質的量分數減小,故b錯誤;
c.催化劑改變反應速率不改變化學平衡,反應速率增大,但平衡不變,故c錯誤;
d.恒容條件下再充入1molCO,2mol H2 ,相當于增大壓強平衡正向進行,CH3OH物質的量分數增大,故d正確;
e.壓縮體積壓強增大反應速率增大平衡正向進行,CH3OH物質的量分數增大,故e正確;
f.移走一部分CH3OH平衡正向進行,濃度減小反應速率減小,故f錯誤,
故de正確,
故答案為:<;250℃,d e;
②由此電解原理可知,陽極失去電子生成二氧化碳氣體,加入碳酸鈉,碳酸鈉與二氧化碳反應生成碳酸氫鈉,陰極CO得到電子生成甲烷氣體,據此離子反應方程式為:4CO+3CO32-+5H2O=6HCO3-+CH4↑,陰極區電極反應式為:CO+6e-+5H2O=6OH-+CH4,
故答案為:CO+6e-+5H2O=6OH-+CH4;
點評 本題考查了熱化學方程式書寫,化學平衡影響因素分析判斷,原電池原理和電極反應書寫方法,化學平衡常數的計算等知識,題目難度中等.


 激活思維優加課堂系列答案
激活思維優加課堂系列答案 活力試卷系列答案
活力試卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 空氣中電子式為${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$的分子含量過多會造成溫室效應 | |
| B. | 結構示意圖為 的陰離子都不能破壞水的電離平衡 的陰離子都不能破壞水的電離平衡 | |
| C. | 球棍模型為 的分子可發生加成反應 的分子可發生加成反應 | |
| D. | 電子式分別為Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+和H${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H的兩種化合物均為常見的氧化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀釋后,c(H+)與c(OH-)的乘積不變 | |
| C. | pH相同的①CH3COONa、②NaClO二種溶液的c(Na+):①<② | |
| D. | 0.1 mol/L Na2SO3溶液:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化鋁溶液中加入過量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 過量鐵粉溶于稀硝酸:Fe+NO3-+4H+═Fe3++2H2O+NO↑ | |
| C. | 氯氣與水的反應:H2O+Cl2═2H++Cl-+ClO- | |
| D. | 向明礬溶液中滴加Ba(OH)2溶液,使沉淀物質的量最大:2Al3++3 Ba2++3SO42-+6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2有漂白性,所以能使滴有酚酞的NaOH溶液褪色 | |
| B. | SO2、漂白粉、活性炭、Na2O2都能使紅墨水褪色,其原理相同 | |
| C. | 能使品紅溶液褪色的不一定是SO2 | |
| D. | SO2和Cl2都能漂白,若將兩種氣體同時通入,漂白效果會更好 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
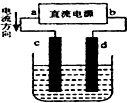
| A. | c、d電極上都有氣體產生 | B. | d為陰極、c為陽極 | ||
| C. | d極附近溶液PH值升高 | D. | 電解過程中,氯離子濃度減小 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com