
分析 (1)CO2的相對分子質量是44,并結合m=nM計算;
(2)根據n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$,結合摩爾質量與相對分子質量的關系以及分子的組成原子的原子結構計算;
(3)CO2中含有的氧原子物質的量為CO2的2倍,H2O含有的氧原子物質的量與H2O的物質的量相等,二者含有氧原子個數相同,則含有氧原子物質的量相等,據此計算;
(4)物質的量相等時,質量之比等于摩爾質量之比;
(5)NH3與CH4中氫原子個數之比為3:4.
解答 解:(1)CO2的相對分子質量是44,CO2的摩爾質量是44g/mol,m=nM=1mol×44g/mol=44g,故答案為:44;44g/mol;44g;
(2)1.7g NH3的物質的量為n=$\frac{m}{M}$=$\frac{1.7g}{17g/mol}$=0.1mol;標準狀況下的體積為V=nVm=0.1mol×22.4L/mol=2.24L;含有氫原子的物質的量為0.3mol,與氨氣所含H原子數相同的H2S的物質的量為0.15mol,則其體積為0.15mol×22.4L/mol=3.36L,
故答案為:0.1mol;2.24L;3.36;
(3)每個CO2分子含有2個O原子,故CO2中含有的氧原子物質的量為CO2的2倍,1.5molCO2含有氧原子物質的量=1.5mol×2=3mol,H2O含有的氧原子個數與1.5mol CO2中含有的氧原子數相同,則含有氧原子物質的量相等,H2O含有的氧原子物質的量與H2O的物質的量相等,故水的物質的量為3mol,
故答案為:3;
(4)物質的量相等時,質量之比等于摩爾質量之比,故等物質的量的NH3和CH4混合,混合氣體中NH3與CH4的質量比等于17:16,故答案為:17:16;
(5)NH3與CH4中氫原子個數之比為3:4,故要使NH3與CH4含相同數目的H原子,則NH3和CH4的物質的量之比為4:3,故答案為:4:3.
點評 本題考查物質的量的計算,為高頻考點,側重于學生的分析、計算能力的考查,題目難度不大,注意有關計算公式的運用和物質的結構和組成.


 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:高中化學 來源: 題型:實驗題
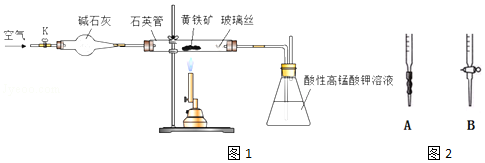
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 混合氣體中二氧化碳與一氧化碳的物質的量各為1:1 | |
| B. | 混合氣體緩慢通過足量的氫氧化鈉溶液后,剩余的氣體是一氧化碳 | |
| C. | 混合氣體的平均相對分子質量為36g•mol-1 | |
| D. | 根據題給條件無法計算混合氣體在標準狀況下的密度 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| A | B |
| ②使溴的四氯化碳溶液褪色; ②比例模型為: 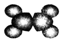 ③能與水在一定條件下反應生成醇 | ①由C、H兩種元素組成; ②球棍模型為: 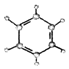 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在常溫常壓下,11.2 L N2含有分子數為0.5 NA | |
| B. | 在常溫常壓下,22.4 L Ne含有分子數為NA | |
| C. | 71 g Cl2所含原子數為2 NA | |
| D. | 在同溫同壓下,相同體積的任何氣體單質所含原子數相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某溶液$\stackrel{+石蕊}{→}$溶液呈紅色:原溶液是酸溶液 | |
| B. | 某溶液$\stackrel{+鹽酸酸化}{→}$無明顯現象$\stackrel{+BaCl_{2}溶液}{→}$有白色沉淀:原溶液中含SO42- | |
| C. | 某溶液$\stackrel{+酚酞}{→}$溶液呈紅色:原溶液是堿溶液 | |
| D. | 某溶液$\stackrel{+稀硫酸}{→}$生成無色無味氣體,說明原溶液中有CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用酒精萃取溴水中的溴單質的操作可選用分液漏斗,而后靜置分液 | |
| B. | 分液時,分液漏斗下層液體從下口放出,上層液體從上口倒出 | |
| C. | 先在天平兩個托盤上各放一張相同質量的紙,再把氫氧化鈉固體放在紙上稱 | |
| D. | 萃取,分液前不需對分液漏斗檢漏 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某溶液中水電離出的c(H+)=10-13,則該溶液的pH一定為13 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | pH相同的氨水與鹽酸等體積混合,所得溶液pH<7 | |
| D. | pH=7的CH3COOH與CH3COONa混合溶液中,c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
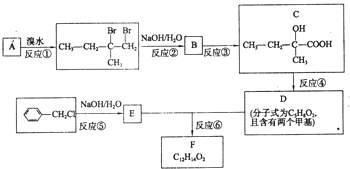 分子式為C12H14O2的有機物F廣泛用于制備香精的調香劑.為了合成該有機物,某實驗室的科技人員設計了下列合成路線.
分子式為C12H14O2的有機物F廣泛用于制備香精的調香劑.為了合成該有機物,某實驗室的科技人員設計了下列合成路線.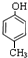 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com