
| A. | 混合氣體中二氧化碳與一氧化碳的物質的量各為1:1 | |
| B. | 混合氣體緩慢通過足量的氫氧化鈉溶液后,剩余的氣體是一氧化碳 | |
| C. | 混合氣體的平均相對分子質量為36g•mol-1 | |
| D. | 根據題給條件無法計算混合氣體在標準狀況下的密度 |
分析 A.設二氧化碳、CO物質的量分別為xmol、ymol,根據二者總質量、總物質的量列方程計算各自物質的量;
B.二氧化碳為酸性氣體,能夠與氫氧化鈉反應,一氧化碳不溶于水,與氫氧化鈉不反應;
C.依據M=$\frac{m}{n}$計算氣體平均摩爾質量,摩爾質量以g/mol為單位數值上等于相對分子質量;
D.依據V=nVm、ρ=$\frac{m}{V}$計算氣體的密度.
解答 解:A.設二氧化碳、CO物質的量分別為xmol、ymol,根據二者總質量、總物質的量可得:
x+y=0.3
44x+28y=10.8
解得x=y=0.15,所以二者物質的量之比為1:1,故A正確;
B.二氧化碳為酸性氣體,能夠與氫氧化鈉反應,一氧化碳不溶于水,與氫氧化鈉不反應,所以混合氣體緩慢通過足量的氫氧化鈉溶液后,剩余的氣體是一氧化碳,故B正確;
C.混合氣體的平均摩爾質量為M=$\frac{10.8g}{0.3mol}$=36g/mol,所以其混合氣體的平均相對分子質量為36,故C錯誤;
D.標準狀況下,混合氣體的體積為0.3mol×22.4L/mol=6.72L,則其密度為$\frac{10.8g}{6.72L}$=1.61g/L,故D錯誤;
故選:CD.
點評 本題考查了物質的量有關計算,明確以物質的量為核心的計算公式是解題關鍵,注意摩爾質量與相對分子質量的關系.


科目:高中化學 來源: 題型:選擇題
| A. | 只測定它的C、H比 | |
| B. | 只需證明它完全燃燒后產物只有H2O和CO2 | |
| C. | 只測定其燃燒產物中H2O與CO2的物質的量的比值 | |
| D. | 測定該試樣的質量及試樣完全燃燒后生成CO2和H2O的質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗①和②均能證明K2Cr2O7溶液中存在上述平衡 | |
| B. | 實驗②能說明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀釋K2Cr2O7溶液時,溶液中各離子濃度均減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 標準狀況下,22.4L四氯化碳的分子數約為NA | |
| B. | 2.4g金屬鎂變為鎂離子時失去的電子數為0.2NA | |
| C. | 16gO2和O3的混合氣體中所含的原子數為NA | |
| D. | 1mo1•L-1的A1C13溶液中,C1-離子的數目為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
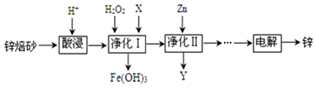
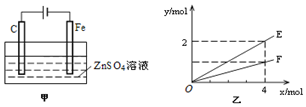
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 實驗編號 | T(℃) | NO初始濃度 (mol/L) | C O初始濃度 (mol/L) | 催化劑的比表面積 (m2/g) |
| 1 | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| 2 | 124 | |||
| 3 | 350 | 124 |
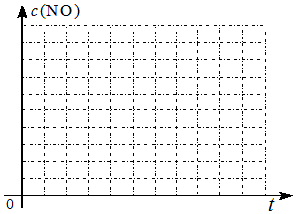
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | 反應物 | 產物 |
| ① | Na2O2、MnO4-、H+ | Mn2+、O2、H2O、Na+ |
| ② | Na2O2、H2O | NaOH、O2 |
| ③ | Na2O2、FeSO4 | Na2FeO4 |
| A. | 三組中Na2O2均作氧化劑 | |
| B. | 第②組反應中生成1molO2,轉移電子的物質的量為4mol | |
| C. | 第③組反應中產物還有Na2SO4 | |
| D. | 氧化性的強弱順序為Na2O2>MnO4->FeO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com