
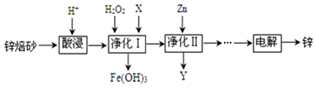
分析 將鋅焙砂(主要含ZnO、ZnFe2O4,還含有少量FeO、CuO等氧化物雜質)酸浸,發生反應ZnFe2O4+8H+=Zn2++2Fe3++4H2O、ZnO+2H+=Zn2++H2O、FeO+2H+=Fe2++H2O、CuO+2H+=Cu2++H2O,向溶液中加入雙氧水,發生反應2Fe2++2H++H2O2=2 Fe3++2H2O,調節溶液的pH將Fe3+轉化為Fe(OH)3沉淀,調節溶液pH時不能引進新的雜質,可以用ZnO,所以X為ZnO,然后向溶液中加入Zn,發生反應Cu2++Zn=Zn2++Cu,然后過濾,所以Y中含有Cu,最后電解得到Zn,
(1)①ZnFe2O4中鋅的化合價+2價,氧元素化合價-2價,結合化合價代數和為0計算得到Fe的化合價;
②工業上利用反應ZnFe2(C2O4)3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ZnFe2O4+2CO2↑+4CO↑+6H2O制備ZnFe2O4.反應過程中鐵元素化合價+2價變化為+3價,碳元素化合價+3價變化為+4價好+2價;
(2)酸浸時要將鋅焙砂粉碎,其目的是提高酸浸效率.為達到這一目的,還可采用的措施是增大硫酸的濃度或升高溫度、空氣攪拌等,已知ZnFe2O4能溶于酸,則酸浸后溶液中存在的金屬離子有,氧化鋅溶解得到鋅離子、氧化亞鐵溶解得到亞鐵離子、氧化銅溶解得到銅離子、ZnFe2O4能溶于酸得到鐵離子;
(3)化Ⅰ中H2O2參與反應是雙氧水具有氧化性,能將亞鐵離子氧化為鐵離子,試劑X的作用是調節溶液PH,促進Fe3+水解生成氫氧化鐵沉淀除去;
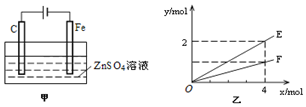
(4)由甲可知,為電解裝置,C為陽極,發生4OH--4e-=O2↑+2H2O,Cu為陰極,發生Cu2++2e-=Cu;由乙可知,轉移4mol電子生成2molE,E為Cu,生成1molF,F為氧氣,以此來解答.
解答 解:將鋅焙砂(主要含ZnO、ZnFe2O4,還含有少量FeO、CuO等氧化物雜質)酸浸,發生反應ZnFe2O4+8H+=Zn2++2Fe3++4H2O、ZnO+2H+=Zn2++H2O、FeO+2H+=Fe2++H2O、CuO+2H+=Cu2++H2O,向溶液中加入雙氧水,發生反應 2Fe2++2H++H2O2=2 Fe3++2H2O,調節溶液的pH將Fe3+轉化為Fe(OH)3沉淀,調節溶液pH時不能引進新的雜質,可以用ZnO,所以X為ZnO,然后向溶液中加入Zn,發生反應Cu2++Zn=Zn2++Cu,然后過濾,所以Y中含有Cu,最后電解得到Zn,
(1)①ZnFe2O4中鋅的化合價+2價,氧元素化合價-2價,結合化合價代數和為0計算得到Fe的化合價,+2+x×2+(-2)×4=0,x=+3,從物質分類角度說,物質是酸根離子和金屬陽離子構成,所以ZnFe2O4屬于鹽,
故答案為:+3;鹽;
②工業上利用反應ZnFe2(C2O4)3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ZnFe2O4+2CO2↑+4CO↑+6H2O制備ZnFe2O4.反應過程中鐵元素化合價+2價變化為+3價,碳元素化合價+3價變化為+4價好+2價,則氧化產物為:ZnFe2O4、CO2,每生成1mol ZnFe2O4,碳元素化合價+3價變化為+2價降低得到電子,每生成1mol ZnFe2O4,生成4molCO轉移電子的物質的量是4mol,
故答案為:ZnFe2O4、CO2;4mol;
(2)酸浸時要將鋅焙砂粉碎,其目的是提高酸浸效率.為達到這一目的,還可采用的措施是增大硫酸的濃度或升高溫度、空氣攪拌等,已知ZnFe2O4能溶于酸,則酸浸后溶液中存在的金屬離子有,氧化鋅溶解得到鋅離子、氧化亞鐵溶解得到亞鐵離子、氧化銅溶解得到銅離子、ZnFe2O4能溶于酸得到鐵離子,所以得到的金屬離子有:Zn2+、Fe3+、Fe2+、Cu2+,
故答案為:增大硫酸的濃度或升高溫度、空氣攪拌等;Zn2+、Fe3+、Fe2+、Cu2+;
(3)凈化Ⅰ中H2O2參與反應是雙氧水具有氧化性,能將亞鐵離子氧化為鐵離子,離子方程式為:H2O2+2Fe2++2H+═2Fe3++2H2O,試劑X的作用是調節溶液PH,促進Fe3+水解生成氫氧化鐵沉淀除去,
故答案為:H2O2+2Fe2++2H+═2Fe3++2H2O;調節溶液的pH,促進Fe3+水解;
(4)由甲可知,為電解裝置,C為陽極,發生4OH--4e-=O2↑+2H2O,Cu為陰極,發生Cu2++2e-=Cu,總反應為2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4,結合乙可知,轉移4mol電子生成2molE,生成1molF,
①C為陽極,電極的電極反應式為:4OH--4e-=O2↑+2H2O,
故答案為:4OH--4e-=O2↑+2H2O;
②由總反應可知,Cu與水的物質的量相同,則E表示反應消耗水的物質的量,由電子與物質的物質的量的關系可知E表示反應生成鋅的物質的量,也可以為生成硫酸的物質的量,
故答案為:消耗水的物質的量、生成Zn的物質的量、生成硫酸的物質的量.
點評 本題考查物質的分離和提純,為高考高頻點,側重考查學生分析、判斷、知識運用及基本操作能力,能從整體上分析解答,知道流程圖中每個步驟發生的反應、操作方法,題目難度中等.


科目:高中化學 來源: 題型:解答題
 鋼鐵很容易生銹而被腐蝕,每年因腐蝕而損失的鋼材占世界鋼鐵年產量的四分之一.
鋼鐵很容易生銹而被腐蝕,每年因腐蝕而損失的鋼材占世界鋼鐵年產量的四分之一.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 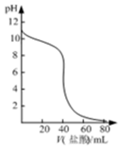 表示常溫下鹽酸滴加到0.1mol/L某強堿溶液得到的滴定曲線 | |
| B. | 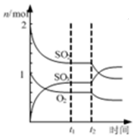 表示一定條件下進行的反應2SO2+O2?2SO3各成分的物質的量變化,t2時刻改變的條件可能是縮小容器體積 | |
| C. | 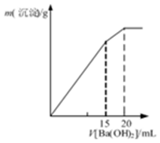 表示某明礬溶液中加入Ba(OH)2溶液,沉淀的質量與加入Ba(OH)2溶液體積的關系,在加入20mlBa(OH)2溶液時鋁離子恰好沉淀完全 | |
| D. | 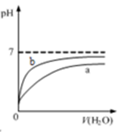 表示pH相同的鹽酸與醋酸中分別加入水后溶液pH的變化,其中曲線a對應的是鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①③④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 混合氣體中二氧化碳與一氧化碳的物質的量各為1:1 | |
| B. | 混合氣體緩慢通過足量的氫氧化鈉溶液后,剩余的氣體是一氧化碳 | |
| C. | 混合氣體的平均相對分子質量為36g•mol-1 | |
| D. | 根據題給條件無法計算混合氣體在標準狀況下的密度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.5mol | B. | 5mol | C. | 25mol | D. | 250mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在常溫常壓下,11.2 L N2含有分子數為0.5 NA | |
| B. | 在常溫常壓下,22.4 L Ne含有分子數為NA | |
| C. | 71 g Cl2所含原子數為2 NA | |
| D. | 在同溫同壓下,相同體積的任何氣體單質所含原子數相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| CH3COOH?CH3COO-+H+ | |||
| 平衡移動方向 | c(H+) | 導電能力 | |
| (1)加水稀釋 | |||
| (2)滴加濃鹽酸 | |||
| (3)加NaOH | |||
| (4)加醋酸銨 | |||
| (5)升高溫度 | |||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com