
pC類似pH,是指極稀溶液中,溶質物質的量濃度的常用對數負值。如某溶液溶質的濃度為1×10-3mol·L-1,則該溶液中溶質的pC=-lg(1×10-3)=3。下圖為,H2CO3在加入強酸或強堿溶液后,平衡時溶液中三種成分的pC—pH圖。請回答下列問題:

(1)在人體血液中,HC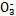 能起到使人體血液pH保持在7.35~7.45的作用。①請用電解質溶液中的平衡解釋: (用離子方程式表示)。
能起到使人體血液pH保持在7.35~7.45的作用。①請用電解質溶液中的平衡解釋: (用離子方程式表示)。
②正常人體血液中,HC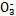 的水解程度 電離程度(填“<”“>”或“=”)。
的水解程度 電離程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c(HC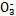 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一級電離平衡常數的數值 ≈ 。
≈ 。
(3)某同學認為該溶液中Na2CO3的水解是微弱的,發生水解的C 不超過其總量的10%。請你設計簡單實驗證明該同學的觀點是否正確
不超過其總量的10%。請你設計簡單實驗證明該同學的觀點是否正確
。
(4)已知某溫度下Li2CO3的Ksp為1.68×10-3,將適量Li2CO3固體溶于100 mL水中至剛好飽和,飽和Li2CO3溶液中c(Li+)=0.15 mol·L-1、c(C )=0.075 mol·L-1。若t1時刻在上述體系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式計算說明是否有沉淀產生。
)=0.075 mol·L-1。若t1時刻在上述體系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式計算說明是否有沉淀產生。
(1)①HC
 H++C
H++C 、HC
、HC +H2O
+H2O H2CO3+OH- ②> ③<
H2CO3+OH- ②> ③<
(2)1
(3)用pH試紙(或pH計)測常溫下0.1 mol·L-1 Na2CO3溶液的pH,若pH<12,該同學的觀點正確;若pH>12,則該同學的觀點錯誤
(4)c(Li+)=0.075 mol·L-1、c(C )=0.1 mol·L-1,c2(Li+)·c(C
)=0.1 mol·L-1,c2(Li+)·c(C )=5.6×1
)=5.6×1 <1.68×10-3,所以無沉淀產生
<1.68×10-3,所以無沉淀產生
【解析】(1)①依據信息抓住HC 既能水解也能電離分析;②由信息可知正常人體血液顯堿性,所以水解大于電離;③由圖像可知c(H2CO3)=c(HC
既能水解也能電離分析;②由信息可知正常人體血液顯堿性,所以水解大于電離;③由圖像可知c(H2CO3)=c(HC )時溶液顯酸性,顯中性時c(HC
)時溶液顯酸性,顯中性時c(HC )>c(H2CO3);(2)
)>c(H2CO3);(2) ,pH=6時c(H2CO3)=c(HC
,pH=6時c(H2CO3)=c(HC ),所以
),所以 =c(H+);(3)由C
=c(H+);(3)由C +H2O
+H2O HC
HC +OH-可知測一定濃度的Na2CO3溶液中c(OH-)即可求出已水解的Na2CO3的濃度;(4)注意最后溶液的體積為原體積的2倍。
+OH-可知測一定濃度的Na2CO3溶液中c(OH-)即可求出已水解的Na2CO3的濃度;(4)注意最后溶液的體積為原體積的2倍。


 華東師大版一課一練系列答案
華東師大版一課一練系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化學 來源:2013-2014學年高考化學二輪沖刺非選擇題增分專練 綜合實驗設計練習卷(解析版) 題型:實驗題
某小組取一定質量的FeSO4固體,利用下圖裝置進行實驗。

實驗 | 實驗過程 | 實現現象 |
① | 通入一段時間N2,加熱 | A中固體變為紅棕色,B中有白色沉淀,D試管中有無色液體 |
② | 用帶有火星的木條靠近裝置D的導管口 | 木條復燃 |
③ | 充分反應,停止加熱,冷卻后,取A中固體,加鹽酸 | 固體溶解,溶液呈黃色 |
④ | 將③所得溶液滴入D試管中 | 溶液變為淺綠色 |
已知:SO2熔點-72℃,沸點-10℃;SO3熔點16.8℃,沸點44.8 ℃。
(1)實驗③反應的離子方程式是_____________________________________________。
(2)分解過程除產生使木條復燃的氣體外,僅由A中固體顏色變化推測,還一定有________氣體,依據是____________________________________________________
(3)實驗④反應的離子方程式是_____________________________________________。
(4)某同學依據B中的現象,認為FeSO4分解一定有SO3生成。你認為是否正確,并說明原因:____________________________________________(用必要的文字和化學方程式解釋)。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪沖刺選擇題限時提速專練 定量分析練習卷(解析版) 題型:選擇題
相同溫度下,體積均為0. 25 L的兩個恒容密閉容器中發生可逆反應:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。實驗測得起始時的有關數據如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。實驗測得起始時的有關數據如表所示:
容器 編號 | 起始時各物質的物質的量/mol | 達到平衡時體 系能量的變化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出熱量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出熱量:Q |
下列敘述錯誤的是( )
A.容器①②中反應的平衡常數相等
B.平衡時,兩個容器中NH3的體積分數均為
C.容器②中達到平衡時放出的熱量Q=23.15 kJ
D.若容器①體積為0.5 L,則平衡時放出的熱量小于23.15 kJ
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 離子反應、氧化還原反應練習卷(解析版) 題型:實驗題
某小組查文獻得知:氧化性I >Fe3+>I2,3Br2+6FeCl2
>Fe3+>I2,3Br2+6FeCl2 2FeBr3+4FeCl3;I2+2S2
2FeBr3+4FeCl3;I2+2S2
 S4
S4 +2I-;CuI是一種白色沉淀(Ksp=1.3×1
+2I-;CuI是一種白色沉淀(Ksp=1.3×1 )。
)。
Ⅰ.該小組為確定一份加碘鹽(可能含有KIO3、KI、Mg2+、Fe3+)的成分,設計定性實驗加以猜想和驗證。
(1)實驗過程如下:
實驗步驟 | 實驗過程和現象 | 對應結論 | |
步驟1 | 取一定量碘鹽,用適量蒸餾水溶解,并加稀鹽酸酸化,將所得試液分為3份 |
_____________ | |
步 驟 2 | 第①份 試液 |
| 碘鹽中肯定含 |
第②份 試液 |
|
_____________ | |
第③份 試液 |
| X為 (填化學式) | |
(2)該碘鹽中肯定不含的物質是 (用化學式或離子符號表達)。
(3)根據信息推斷Fe3+、S4 、I2、Br2的氧化性由強到弱的順序是 。
、I2、Br2的氧化性由強到弱的順序是 。
(4)第③份試液中加入足量KI固體后,反應的離子方程式為 、 。
Ⅱ.用“間接碘量法”測定含有CuCl2·2H2O晶體的試樣(不含能與I-發生反應的氧化性雜質)的純度,過程如下:
取0.40 g試樣溶于水,加入過量KI固體,充分反應,生成白色沉淀。加入淀粉作滴定指示劑,用0.100 0 mol·L-1 Na2S2O3標準溶液滴定,到達滴定終點時,消耗Na2S2O3標準溶液20.00 mL。
(1)滴定終點的現象是 。
(2)CuCl2溶液與KI反應的化學方程式為 。
(3)該試樣中CuCl2·2H2O的質量分數為 。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 離子反應、氧化還原反應練習卷(解析版) 題型:選擇題
下列分子或離子在指定的分散系中能大量共存的一組是( )
A.銀氨溶液:Na+、K+、N 、NH3·H2O
、NH3·H2O
B.空氣:C2H2、CO2、SO2、NO
C.氫氧化鐵膠體:H+、K+、S2-、Br-
D.高錳酸鉀溶液:H+、Na+、S 、葡萄糖分子
、葡萄糖分子
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 電解質溶液與電離平衡練習卷(解析版) 題型:選擇題
25 ℃時,水的電離達到平衡:H2O H++OH-,下列敘述中正確的是( )
H++OH-,下列敘述中正確的是( )
A.將純水加熱到95 ℃時,KW變大,pH不變,水仍呈中性
B.向純水中加入稀氨水,平衡逆向移動,c(OH-)增大,KW變小
C.向純水中加入少量固體碳酸鈉,c(H+)減小,KW不變,影響水的電離平衡
D.向純水中加入醋酸鈉或鹽酸,均可抑制水的電離,KW不變
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 電化學練習卷(解析版) 題型:填空題
某課外小組分別用下圖所示裝置對原電池和電解池原理進行實驗探究。


圖1 圖2
請回答:
Ⅰ.用圖1所示裝置進行第一組實驗。
(1)在保證電極反應不變的情況下,不能替代Cu作電極的是 (填字母序號)。
A.鋁B.石墨C.銀D.鉑
(2)N極發生反應的電極反應為 。
(3)實驗過程中,S (填“從左向右”“從右向左”或“不”)移動;濾紙上能觀察到的現象有 。
(填“從左向右”“從右向左”或“不”)移動;濾紙上能觀察到的現象有 。
Ⅱ.用圖2所示裝置進行第二組實驗。實驗過程中,兩極均有氣體產生,Y極區溶液逐漸變成紫紅色;停止實驗,鐵電極明顯變細,電解液仍然澄清。查閱資料發現,高鐵酸根(Fe )在溶液中呈紫紅色。
)在溶液中呈紫紅色。
(4)電解過程中,X極區溶液的pH (填“增大”“減小”或“不變”)。
(5)電解過程中,Y極發生的電極反應為Fe-6e-+8OH- Fe
Fe +4H2O和 。
+4H2O和 。
(6)若在X極收集到672 mL氣體,在Y極收集到168 mL氣體(均已折算為標準狀況下的氣體體積),則Y電極(鐵電極)質量減少 g。
(7)在堿性鋅電池中,用高鐵酸鉀作為正極材料,電池反應為:
2K2FeO4+3Zn Fe2O3+ZnO+2K2ZnO2
Fe2O3+ZnO+2K2ZnO2
該電池正極發生的反應的電極反應為 。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 物質結構和元素周期律練習卷(解析版) 題型:選擇題
下列判斷中一定正確的是( )
A.若X、Y屬于同主族元素,且相對原子質量:X>Y,則X失電子能力比Y強
B.若M+和 的核外電子層結構相同,則原子半徑:R>M
的核外電子層結構相同,則原子半徑:R>M
C.若X、Y都是氣態氫化物,且相對分子質量:X>Y,則酸性:X>Y
D.若X、Y是同主族元素,且原子序數:X>Y,則非金屬性:X>Y
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com