
 隨原子序數的遞增,八種短周期元素(用字母表示)原子半徑的相對大小、最高正價或最低負價的變化如下圖所示.
隨原子序數的遞增,八種短周期元素(用字母表示)原子半徑的相對大小、最高正價或最低負價的變化如下圖所示. (或
(或
 ).
). 分析 從圖中的化合價、原子半徑的大小及原子序數可知:x是H元素,y是C元素、z是N元素、d是O元素、e是Na元素、f是Al元素、g是S元素、h是Cl元素,
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族;
(2)電子層結構相同的離子,核電荷數越大離子半徑越小;非金屬性越強,最高價氧化物水化物的酸性越強;
(3)四原子共價化合物,可以是NH3、H2O2、C2H2等,根據電子式的書寫原則寫出其電子式.
解答 解:從圖中的化合價、原子半徑的大小及原子序數可知:x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,
(1)f是Al元素,其原子序數為13,在元素周期表中位于第三周期ⅢA族,
故答案為:第三周期ⅢA族;
(2)電子層結構相同的離子,核電荷數越大離子半徑越小,故離子半徑:O2->Na+;非金屬性越強,最高價氧化物水化物的酸性越強,故酸性:HClO4>H2SO4,
故答案為:O2-;Na+;HClO4;H2SO4;
(3)四原子共價化合物,可以是NH3、H2O2、C2H2等,其電子式為: (或
(或
 ),
),
故答案為: (或
(或
 ).
).
點評 本題考查了元素周期表與元素周期律的綜合應用,題目難度中等,明確原子結構與元素周期表、元素周期律的關系為解答關鍵,注意掌握離子半徑比較方法及電子式的書寫原則.


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | 電解飽和食鹽水可以得到氯氣 | |
| B. | 金屬鈉在高溫下能將TiCl4中的鈦置換出來 | |
| C. | 金屬鎂燃燒后會發出耀眼的白光,因此常用來制造信號彈和焰火 | |
| D. | 金屬鎂著火,可用二氧化碳滅火 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
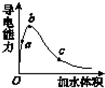 在一定溫度下,向冰醋酸中加水稀釋,溶液導電能力變化情況如圖所示,回答下列問題.
在一定溫度下,向冰醋酸中加水稀釋,溶液導電能力變化情況如圖所示,回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=12的溶液:K+、Na+、CH3COO-、ClO- | |
| B. | 0.1mol•L-1Na2CO3 溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol/LFeCl3溶液中:Al3+、NH4+、SCN-、SO42- | |
| D. | 使紫色石蕊試液變紅的溶液:Fe2+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫離子濃度相同 | |
| B. | 導電能力相同 | |
| C. | 相同體積時,中和NaOH的能力相同 | |
| D. | 加水稀釋10倍后,溶液的pH值均上升1個單位 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖所示裝置為在直流電的作用下電解200molNaCl溶液圖,其中A、B為石墨電極,a、b為電源的兩極,當接通電源,通電一段時間后,B電極產生能使濕潤的淀粉碘化鉀試紙變藍的氣體224mL(標準狀況),則:
如圖所示裝置為在直流電的作用下電解200molNaCl溶液圖,其中A、B為石墨電極,a、b為電源的兩極,當接通電源,通電一段時間后,B電極產生能使濕潤的淀粉碘化鉀試紙變藍的氣體224mL(標準狀況),則:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com