
| A. | c (Cl-)>c (NH4+)>c (OH-)>c (H+) | B. | c (NH4+)>c (Cl-)>c (OH-)>c (H+) | ||
| C. | c (NH4+)>c (Cl-)>c (H+)>c (OH-) | D. | c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
分析 x+y=14,常溫下該氨水的pH=x,則氨水中c(OH-)=10x-14mol/L=10-ymol/L;該鹽酸的pH=y,鹽酸中c(H+)=10-ymol/L,所以氨水中c(OH-)等于鹽酸中c(H+),一水合氨是弱電解質,氯化氫是強電解質,所以氨水濃度大于鹽酸,二者等體積混合,氨水過量,溶液呈堿性,根據質子守恒判斷溶液中各離子濃度大小.
解答 解:常溫下該氨水的pH=x,則氨水中c(OH-)=10x-14mol/L,
該鹽酸的pH=y,鹽酸中c(H+)=10-ymol/L,由于x+y=14,則c(H+)=10-ymol/L=10x-14mol/L,
所以氨水中c(OH-)與鹽酸中c(H+)相等,一水合氨是弱電解質,氯化氫是強電解質,氨水濃度大于鹽酸,二者等體積混合后氨水過量,溶液呈堿性,則c(OH-)>c(H+),
根據電荷守恒得c(NH4+)+c(H+)=c(Cl-)+c(OH-)可得:c(NH4+)>c(Cl-),
所以溶液中離子濃度大小關系為:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故選B.
點評 本題考查了酸堿混合溶液定性判斷及溶液pH的簡單計算,題目難度中等,明確溶液中的溶質及其性質是解本題關鍵,注意電荷守恒、物料守恒在比較離子濃度大小關系中的應用.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 回收電池中的石墨電極 | |
| B. | 回收電池外殼金屬材料 | |
| C. | 防止電池中汞、鎘、銅等重金屬對土壤和水源的污染 | |
| D. | 防止電池中的滲出液腐蝕其它物品 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10.0g | B. | 15.0g | C. | 16.7g | D. | 18.8g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C氣體的體積分數增大 | B. | 平衡向逆反方向移動 | ||
| C. | 氣體A的轉化率升高 | D. | m+n>p |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
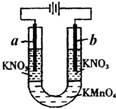 如圖所示的實驗可以證明KMnO4溶液的紫色是由于MnO4-離子存在的緣故,且不破壞MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的兩液面上加入KNO3溶液,將石墨電極插入KNO3溶液中,接通直流電源.
如圖所示的實驗可以證明KMnO4溶液的紫色是由于MnO4-離子存在的緣故,且不破壞MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的兩液面上加入KNO3溶液,將石墨電極插入KNO3溶液中,接通直流電源.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

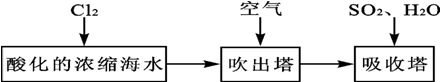

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com