
【題目】a~n10中元素在周期表中的位置如圖所示,請回答下列問題:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
(1)m的陰離子的結構示意圖為___。
(2)b的最高價氧化物的化學式為___;用化學方程式表示f、d的單質形成f2d2的過程___。
(3)d、g、n形成的簡單離子的半徑由大到小的順序為___(用離子符號表示)。
(4)以上元素組成的物質有下列框圖中的轉化關系,其中甲為10電子微粒。
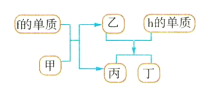
請寫出h的單質與乙反應的化學方程式:___。
【答案】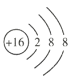 CO2 2Na+O2
CO2 2Na+O2![]() Na2O2 Cl->O2->Mg2+ 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
Na2O2 Cl->O2->Mg2+ 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
【解析】
根據a~n這10種元素在周期表中的位置可判斷,它們分別是H、C、N、O、Ne、Na、Mg、Al、S、Cl,
(1)S2-的核電荷數為16,核外電子數為18,故其結構示意圖為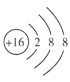 ;
;
(2)b為C,其最高價氧化物是CO2;Na在空氣中受熱生成Na2O2,其化學方程式為:2Na+O2![]() Na2O2;
Na2O2;
(3)核外電子層數越多,離子半徑越大,核外電子排布相同時離子半徑隨原子序數的增大而減小,Cl-核外有3個電子層,Mg2+與O2-核外有2個電子層,且二者電子層結構相同,則d、g、n形成的簡單離子的半徑由大到小的順序為![]() ;
;
(4)常見10電子微粒有CH4、NH3、H2O、HF等,f為Na,h為Al,Na與某10電子微粒反應的產物能與Al反應,則甲為H2O,則乙為NaOH,丙為H2,Al與NaOH反應生成![]() 和H2,丁是
和H2,丁是![]() ,Al與NaOH反應的化學方程式為:
,Al與NaOH反應的化學方程式為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】氮的氧化物是造成大氣污染的主要物質。研究氮氧化物的反應機理對于消除環境污染有重要意義。
(1)NO在空氣中存在如下反應:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反應分兩步完成,其反應歷程如下圖所示:
2NO2(g) △H,上述反應分兩步完成,其反應歷程如下圖所示:

回答下列問題:
①寫出反應I的熱化學方程式_________。
②反應I和反應Ⅱ中,一個是快反應,會快速建立平衡狀態,而另一個是慢反應。決定2NO(g)+O2(g)![]() 2NO2(g)反應速率的是_______(填“反應I”或“反應Ⅱ”);對該反應體系升高溫度,發現總反應速率反而變慢,其原因可能是__________(反應未使用催化劑)。
2NO2(g)反應速率的是_______(填“反應I”或“反應Ⅱ”);對該反應體系升高溫度,發現總反應速率反而變慢,其原因可能是__________(反應未使用催化劑)。
(2)用活性炭還原法處理氮氧化物的有關反應為:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密閉容器中加入一定量的活性炭和NO,T℃時,各物質起始濃度及10min和20min各物質平衡濃度如表所示:
N2(g)+CO2(g)。向恒容密閉容器中加入一定量的活性炭和NO,T℃時,各物質起始濃度及10min和20min各物質平衡濃度如表所示:

①T℃時,該反應的平衡常數為_____________________(保留兩位有效數字)。
②在10min時,若只改變某一條件使平衡發生移動,20min時重新達到平衡,則改變的條件是__________________________________。
③在20min時,保持溫度和容器體積不變再充入NO和N2,使二者的濃度均增加至原來的兩倍,此時反應v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定條件下NO2與N2O4的消耗速率與各自的分壓(分壓=總壓×物質的量分數)有如下關系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相應的速率與其分壓關系如圖所示。
N2O4(g) △H<0,在一定條件下NO2與N2O4的消耗速率與各自的分壓(分壓=總壓×物質的量分數)有如下關系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相應的速率與其分壓關系如圖所示。

一定溫度下,k1、k2與平衡常數kp(壓力平衡常數,用平衡分壓代替平衡濃度計算)間的關系是k1=____________;在上圖標出點中,指出能表示反應達到平衡狀態的點是___,理由是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4g氫氧化鈉和mg碳酸鈉混合并配成溶液,向溶液中滴加一定濃度的稀鹽酸,加入鹽酸的體積和生成二氧化碳的質量的關系如圖所示,回答下列問題:(不考慮二氧化碳的溶解)
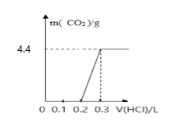
(1)加入鹽酸的體積為0.2L時,溶液中溶質的成分為___;
(2)碳酸鈉的質量m=___;
(3)鹽酸的物質的量濃度為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學在畫某種元素的一種單核微粒的結構示意圖時,忘記在圓圈內標出其核電荷數,請你根據下面的提示做出自己的判斷。
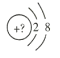
(1)若該微粒是電中性微粒,這種微粒的元素符號是___。
(2)若該微粒的還原性很弱,失去1個電子后變為原子,該原子的單質氧化性很強,該單質與水反應的化學方程式為___。
(3)若該微粒的氧化性很弱,得到1個電子后變為原子,該原子的單質還原性很強,該單質在氧氣中燃燒所得產物的化學式為___。
(4)若該微粒的還原性很弱,失去2個電子后變成原子,其氫化物的結構式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:①向KMnO4晶體滴加濃鹽酸,產生黃綠色氣體;②向FeCl2溶液中通入少量實驗①產生的氣體,溶液變黃色;③取實驗②生成的溶液滴在淀粉KI試紙上,試紙變藍色。下列判斷正確的是( )
A.上述實驗中,共有兩個氧化還原反應
B.上述實驗證明氧化性:![]() >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
C.實驗①生成的氣體不能使濕潤的淀粉KI試紙變藍
D.實驗②證明Fe2+既有氧化性又有還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應:![]() ,當其他條件不變,只改變一個反應條件時,將生成SO3的速率的變化填入表格(填寫“增大”“減小”或“不變”)。
,當其他條件不變,只改變一個反應條件時,將生成SO3的速率的變化填入表格(填寫“增大”“減小”或“不變”)。
編號 | 改變的條件 | 生成SO3的速率 |
① | 升高溫度 | _______ |
② | 降低溫度 | _______ |
③ | 增大O2的濃度 | _______ |
④ | 使用V2O5作催化劑 | _______ |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T℃時,將2.0molA(g)和2.0molB(g)充入體積為1L的密閉容器中,在一定條件發生下述反應:A(g)+B(g)![]() 2C(g)+D(s)△H<0;t時刻反應達到平衡時,C(g)為2.0mol。下列說法正確的是
2C(g)+D(s)△H<0;t時刻反應達到平衡時,C(g)為2.0mol。下列說法正確的是
A. t時刻反應達到平衡時,A(g)的體積分數為20%
B. T℃時該反應的化學平衡常數Kc=2
C. t時刻反應達到平衡后,縮小容器體積,平衡逆向移動
D. 相同條件下,若將1.0molA(g)和1.0molB(g)充入同樣容器,達到平衡后,A(g)的轉化率為50%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,H2(g)+CO2(g)![]() H2O(g)+CO2(g)的平衡常數
H2O(g)+CO2(g)的平衡常數![]() 。該溫度下在甲、乙、丙三個恒容密閉容器中,
。該溫度下在甲、乙、丙三個恒容密閉容器中,
起始濃度 | 甲 | 乙 | 丙 |
c(H2)/mol | 0.010 | 0.020 | 0.020 |
c(CO2)/mol | 0.010 | 0.010 | 0.020 |
投入H2(g)和CO2(g),其起始濃度如表所示。下列判斷不正確的是( )
A.平衡時,乙中CO2的轉化率大于60%
B.平衡時,甲中和丙中H2的轉化率均是60%
C.平衡時,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反應開始時,丙中的反應速率最快,甲中的反應速率最慢
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MnSO4是制備高純MnCO3的中間原料。實驗室用如圖所示裝置可制備少量MnSO4溶液,反應原理為MnO2+H2SO3=MnSO4+H2O。下列說法錯誤的是( )
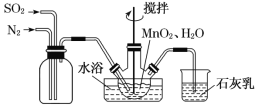
A. 若實驗中將N2換成空氣,則反應液中 的濃度之比變大
的濃度之比變大
B. 緩慢通入混合氣體可提高SO2的轉化率
C. 若不通N2,則燒瓶中的進氣管口容易被堵塞
D. 石灰乳對尾氣的吸收效果比澄清石灰水更好
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com