
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
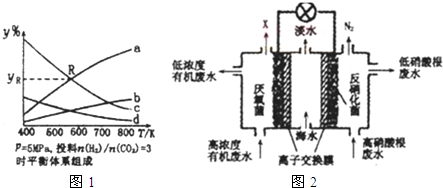
分析 (1)①該反應為吸熱反應,升高溫度平衡正向移動,平衡時CO2與H2的含量降低,CH3CH2OH與H2O的含量增大.開始CO2 與H2 的物質的量之比1:3進行,平衡時H2的含量是CO2的含量三倍;CH3CH2OH與H2O按1:3生成,平衡時H2O的含量是CH3CH2OH含量的三倍;
②R點為a和c的交點,設此時a的H2O體積為V,那么c的H2體積也為V,根據方程式中的關系求出CO2和CH3CH2OH的體積,再求體積分數yR;
(2)H2CO3、HCO3-和HSO3-的電離平衡常數分別是:4.40×10-7、4.7×10-11、6.3×10-8,所以酸性順序是:H2CO3>HSO3->HCO3-,化學反應遵循強酸制弱酸的規律;
(3)SrSO4轉化為SrCO3可將兩個離子方程式相減可得到離子方程式SrSO4(s)+CO32-(aq)?SrCO3(s)+SO42-(aq)判斷,以此計算;
(4)該原電池中,硝酸根離子得電子發生還原反應,則右邊裝置中電極b是正極,電極反應式為2NO3-+10e-+12H+=N2↑+6H2O,左邊裝置電極a是負極,負極上有機物失電子發生氧化反應,有機物在厭氧菌作用下生成二氧化碳,電極反應式為C6H10O5-24e-+7H2O═6CO2↑+24H+.
解答 解:(1)①該反應為吸熱反應,升高溫度平衡正向移動,平衡時CO2與H2的含量降低,CH3CH2OH與H2O的含量增大.開始CO2 與H2 的物質的量之比1:3進行,平衡時H2的含量是CO2的含量三倍;CH3CH2OH與H2O按1:3生成,平衡時H2O的含量是CH3CH2OH含量的三倍;
曲線a、曲線b隨溫度升高含量增大,且曲線a的含量高,所以曲線a表示H2O、曲線b表示CH3CH2OH;
曲線c、曲線d隨溫度升高含量減小,且曲線c的含量高,所以曲線c表示H2、曲線d表示CO2.
故答案為:H2O;
②2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g);
R點為a和c的交點,設此時a的H2O體積為6V,那么c的H2體積也為6V,根據方程式可知CO2為$\frac{6V}{6}$=2V,C2H5OH為$\frac{6V}{3}$=2V,
所以R點對應的體積分數yR=$\frac{6V}{6V+6V+2V+2V}$×100%=37.5%,
故答案為:37.5%;
(2)化學反應遵循強酸制弱酸的規律,酸性:HSO3->HCO3-,向Na2CO3溶液中加入足量NaHSO3溶液,反應的離子方程式為CO32-+HSO3-=HCO3-+SO32-,故答案為:CO32-+HSO3-=HCO3-+SO32-;
(3)依據物質Ksp大小可知,SrSO4轉化成SrCO3的溶解性不同,反應向更難溶的方向進行,依據沉淀轉化寫出離子方程式為:SrSO4(s)+CO32-(aq)?SrCO3(s)+SO42-(aq),該反應為SrSO4(s)?Sr2+(aq)+SO42-(aq)Ksp=2.5×10-7,①SrCO3(s)?Sr2+(aq)+CO32-(aq)②,該反應為①-②得到,故平衡常數為:$\frac{2.5×1{0}^{-7}}{2.5×1{0}^{-9}}$=100,
故答案為:100;
(4)①該原電池中,硝酸根離子得電子發生還原反應,電極反應式為2NO3-+10e-+12H+=N2↑+6H2O,則右邊裝置中電極b是正極,故答案為:正;
②左邊裝置電極a是負極,負極上有機物失電子發生氧化反應,有機物在厭氧菌作用下生成二氧化碳,電極反應式為C6H10O5-24e-+7H2O═6CO2↑+24H+,故答案為:C6H10O5-24e-+7H2O═6CO2↑+24H+.
點評 本題考查較為綜合,涉及平衡常數、難溶電解質的溶解平衡等相關知識,題目難度中等,試題有利于培養學生的分析、理解能力及靈活應用所學知識的能力,注意相關基礎知識的積累.


科目:高中化學 來源: 題型:選擇題
| A. | 在AlCl3溶液中:Na+、NH4+、S2O32-、SO42- | |
| B. | 使pH試紙變藍色的溶液中:Cu2+、NO3-、Fe3+、SO42- | |
| C. | 與鋁粉反應放出氫氣的無色溶液中:Na+、Al3+、SO42-、NO3- | |
| D. | 常溫下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中:K+、AlO2-、Na+、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 下列各組物質中,不滿足如圖所示轉化關系的是( )
下列各組物質中,不滿足如圖所示轉化關系的是( )| 選項 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | Cl2 | N2 | H2 |
| B | Fe | H2O | Fe2O3 | CO |
| C | Al(OH)3 | NaOH | NaAlO2 | CO2 |
| D | Br2 | FeCl2 | FeBr3 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗序號 | 實驗 | 預期現象和結論 |
| 實驗Ⅱ | 將實驗I中收集到的氣體點燃 | 能安靜燃燒、產生淡藍色火焰①該氣體為氫氣 |
| 實驗Ⅲ | 取實驗I中的白色不溶物,洗滌,加入足量此空刪去②稀鹽酸 | 產生氣泡,沉淀全部溶解;白色不溶物可能含有MgCO3 |
| 實驗Ⅳ | 取實驗I中的澄清液,向其中加入少量CaCl2溶液 | 產生白色沉淀;溶液中存在此空刪去③CO32-離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | 容器 | 起始時物質的量 mol | 平衡時物質的量/mol | 平衡常數(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒溫 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒溫 | 2 | 3 | m | K2 |
| 3 | 絕熱 | 1 | 1.5 | n | K3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 合理應用和處理氮的化合物,在生產生活中有重要意義.
合理應用和處理氮的化合物,在生產生活中有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol 放出熱量9.2KJ時,轉移電子0.6 NA | |
| B. | 7.2g CaO2晶體中陰離子和陽離子總數為0.3NA | |
| C. | 標準狀況下,11.2L苯中含有碳氫鍵的數目為3NA | |
| D. | 0.1mol H2O2分子中含極性共價鍵數目為0.3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2:3:6 | B. | 6:3:2 | C. | 1:2:3 | D. | 3:2:1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com