

分析 (1)反應熱等于正反應的活化能減去逆反應的活化能,注明物質的聚集狀態與反應熱書寫熱化學方程;
(2)①根據v=$\frac{△c}{△t}$計算v(N2O4);
②溫度升高,混合氣體的顏色變深,說明升高溫度平衡向生成NO2的方向移動;
③a.向混合氣體中通入N2O4,等效為在原平衡基礎上增大壓強到達的平衡;
b.升高溫度,平衡向吸熱反應方向移動;
c.向混合氣體中通入NO2,等效為在原平衡基礎上增大壓強到達的平衡;
d.使用高效催化劑不影響平衡移動;
(3)溶液A中NaNO3、NaNO2的濃度均為0.1mol/L,HNO2、CH3COOH均為弱酸,由電離常數可知CH3COOH酸性小于HNO2的酸性,溶液中醋酸根離子水解程度大于亞硝酸根離子水解程度,溶液B堿性大于A溶液;
(4)參加反應的硝酸轉化為Cu(NO3)2、NO、NO2,根據Cu原子守恒計算Cu(NO3)2的物質的量,根據電子轉移守恒計算NO、NO2的物質的量,再根據氮原子守恒計算消耗硝酸物質的量.
解答 解:(1)該反應的焓變△H=E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol,所以熱化學方程式為:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol,
故答案為:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol;
(2)①由圖可知,在0-60s時段△c(N2O4)=0.1mol/L-0.04mol/L=0.06mol/L,則v(N2O4)=$\frac{0.06mol/L}{60s}$=0.001mol/(L.min),
故答案為:0.001;
②溫度升高,混合氣體的顏色變深,說明升高溫度平衡向生成NO2的方向移動,升高溫度平衡向吸熱反應移動,則△H>0,
故答案為:>;
③a.向混合氣體中通入N2O4,等效為在原平衡基礎上增大壓強到達的平衡,平衡逆向移動,N2O4的體積分數增大,故a正確;
b.正反應為吸熱反應,升高溫度平衡向正反應方向移動,N2O4的體積分數減小,故b錯誤;
c.向混合氣體中通入NO2,等效為在原平衡基礎上增大壓強到達的平衡,N2O4的體積分數增大,故c正確;
d.使用高效催化劑縮短到達平衡的水解,不影響平衡移動,N2O4的體積分數不變,故d錯誤,
故答案為:ac;
(3)0.2mol NaOH的水溶液與0.2mol NO2恰好完全反應得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物質的量濃度為0.1mol/L,NaNO2物質的量濃度為0.1mol/L,溶液B為0.1mol•L-1的CH3COONa溶液;
HNO2的電離常數Ka=7.1×10-4mol•L-1,CH3COOH的電離常數Ka=1.7×10-5mol•L-1,說明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根離子水解程度大于亞硝酸根離子水解程度,溶液B堿性大于A溶液,兩溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的順序為c(NO3-)>c(NO2-)>c(CH3COO-),
a.溶液B堿性大于A溶液,向溶液A中加適量水,稀釋溶液,堿性減弱,不能調節溶液pH相等,故a錯誤;
b.向溶液A中加適量NaOH,增大堿性,可以調節溶液pH相等,故b正確;
c.向溶液B中加適量水,稀釋溶液堿性減弱,可以調節溶液pH相等,故c正確;
d.溶液B堿性大于A溶液,向溶液B中加適量NaOH,溶液pH更大,故d錯誤;
故答案為:c(NO3-)>c(NO2-)>c(CH3COO-);bc;
(4)參加反應的硝酸轉化為Cu(NO3)2、NO、NO2,根據Cu原子守恒可知n[Cu(NO3)2]=n(Cu)=0.6mol,得到的NO和NO2物質的量相同,根據電子轉移守恒,則:3n(NO)+n(NO2)=0.6mol×2,故n(NO)=n(NO2)=0.3mol,根據氮原子守恒,可知n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=0.6mol×2+0.3mol+0.3mol=1.8mol,
故答案為:1.8mol.
點評 本題考查熱化學方程式書寫、化學反應速率計算、化學平衡影響因素、鹽類水解、氧化還原反應計算等,注意等效思想在化學平衡移動中應用,守恒思想在化學計算中應用.


科目:高中化學 來源: 題型:選擇題
| A. | ④③①②⑤ | B. | ④⑤③②① | C. | ④③②①⑤ | D. | ④②③①⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗次數 | 第一次 | 第二次 | 第三次 |
| 消耗高錳酸鉀溶液體積/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原素Z、W的簡單離子的電子層結構不同 | |
| B. | Y的最高價氧化物的水化物能與其簡單氣態氫化物反應生成鹽且顯堿性 | |
| C. | 由X元素形成的單質不一定是原子晶體 | |
| D. | 由X、Y、Z、M四種元素形成的化合物一定既有離子鍵,又有共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| X | Y | ||
| Z | W | Q |
| A. | 陰離子的還原性:W2-<Q-<Y- | |
| B. | 常溫下,X2與W的單質間化合反應不能自發進行 | |
| C. | ZX2是兩性氧化物 | |
| D. | Y的氫化物可用來篆刻玻璃 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
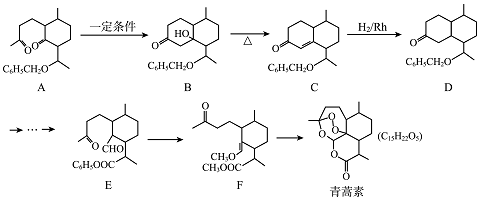
 ,現有相對分子質量最小的該原料的同系物X,檢驗X中碳碳雙鍵的操作方法取試樣X于試管中,加入足量新制氫氧化銅懸濁液加熱,出現磚紅色沉淀后取上清液滴加適量稀硫酸,再加入溴水,若溴水褪色,說明X中含有碳碳雙鍵,寫出X與銀氨溶液發生的離子反應方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.
,現有相對分子質量最小的該原料的同系物X,檢驗X中碳碳雙鍵的操作方法取試樣X于試管中,加入足量新制氫氧化銅懸濁液加熱,出現磚紅色沉淀后取上清液滴加適量稀硫酸,再加入溴水,若溴水褪色,說明X中含有碳碳雙鍵,寫出X與銀氨溶液發生的離子反應方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.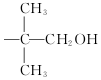 基團;
基團;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 +2H2O.
+2H2O.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com