
| A. | 正反應是吸熱反應,且A不是氣態 | B. | 正反應是放熱反應,且A不是氣態 | ||
| C. | 正反應是吸熱反應,且A是氣態 | D. | 正反應是放反應,且A是氣態 |
分析 根據外界條件(濃度、溫度、壓強)對化學平衡的影響,可以根據平衡移動原理,利用公式ρ=$\frac{m}{V}$,根據容器內氣體的密度增大,來判斷容器內氣體的密度是否增大進行分析.
解答 解:因溫度升高,平衡向吸熱的方向移動,若正反應是吸熱反應,平衡正向移動,如果A為氣態時,根據ρ=$\frac{m}{V}$,m不變,V不變,所以密度不會改變;如果A不是氣態時,根據ρ=$\frac{m}{V}$,m變大,V不變,所以密度不大,所以A正確,C錯誤;
因溫度升高,平衡向吸熱的方向移動,若正反應是放熱反應,平衡逆向移動,如果A為氣態時,根據ρ=$\frac{m}{V}$,m不變,V不變,所以密度不變;如果A不是氣態時,根據ρ=$\frac{m}{V}$,m變小,V不變,所以密度變小,所以B錯誤,D錯誤;
故選A.
點評 本題考查化學平衡,解答本題的關鍵是熟悉外界條件(濃度、溫度、壓強)對化學平衡的影響,注意條件的適用范圍,然后再根據化學平衡移動原理來對問題做出正確的判斷即可,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | NaHSO4溶液中,c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 室溫時水電離出來的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量共存 | |
| C. | 等物質的量濃度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小關系為:②>④>③>① | |
| D. | 在明礬溶液中加入氫氧化鋇溶液至沉淀的質量達到最大值時發生反應的離子方程式:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
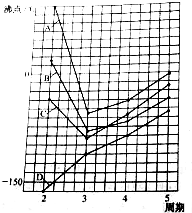 圖中A、B、C、D四條曲線分別表示ⅣA、ⅤA、ⅥA、ⅦA族元素氣態氫化物的沸點.其中表示ⅥA族元素氣態氫化物沸點的是曲線A,表示ⅣA族元素氣態氫化物沸點的是曲線D;同一族中第4、5周期元素氣態氫化物的沸點明顯高于第3周期元素氣態氫化物的沸點,其原因是同一族中第4、5周期元素氣態氫化物都不含氫鍵且分子間作用力大于第三周期氫化物.
圖中A、B、C、D四條曲線分別表示ⅣA、ⅤA、ⅥA、ⅦA族元素氣態氫化物的沸點.其中表示ⅥA族元素氣態氫化物沸點的是曲線A,表示ⅣA族元素氣態氫化物沸點的是曲線D;同一族中第4、5周期元素氣態氫化物的沸點明顯高于第3周期元素氣態氫化物的沸點,其原因是同一族中第4、5周期元素氣態氫化物都不含氫鍵且分子間作用力大于第三周期氫化物.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
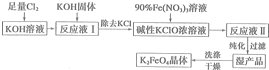

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子總數 | B. | 質量 | C. | 密度 | D. | 原子總數 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com