

分析 (1)裝置1中儀器B的名稱是干燥管;利用分液漏斗滴入液體溶解錐形瓶中的固體,利用溶解放熱使氨水分解生成氨氣,據此書寫方程式;
(2)反應是放熱反應,降溫平衡正向進行;
(3)液體石蠟鼓泡瓶的主要作用是控制反應進行程度,控制氣體流速和原料氣體的配比;
(4)生成的氨基甲酸銨小晶體懸浮在四氯化碳中,分離產品的實驗方法利用過濾得到;
(5)依據反應過程中的產物分析,不能把污染性的氣體排放到空氣中,吸收易溶于水的氣體需要放倒吸;
(6)碳酸氫銨的氨基甲酸銨樣品中,使碳元素完全轉化為碳酸鈣,依據碳元素守恒和混合物質量計算物質的質量分數.
解答 解:(1)裝置1中儀器B的名稱是干燥管;把濃氨水滴入到固體氧化鈣,在溶解過程中放熱使濃氨水分解生成氨氣,則反應方程式為CaO+NH3•H2O=Ca(OH)2+NH3↑,
故答案為:干燥管;CaO+NH3•H2O=Ca(OH)2+NH3↑;
(2)反應2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放熱反應,降溫平衡正向進行,溫度升高;發生器用冰水冷卻提高反應物質轉化率,防止生成物溫度過高分解,
故答案為:降低溫度,提高反應物轉化率(或降低溫度,防止因反應放熱造成產物分解);
(3)液體石蠟鼓泡瓶的作用是控制反應進行程度,控制氣體流速和原料氣體的配比,故答案為:通過觀察氣泡,調節NH3與CO2通入比例;
(4)制備氨基甲酸銨的裝置如圖3所示,把氨氣和二氧化碳通入四氯化碳中,不斷攪拌混合,生成的氨基甲酸銨小晶體懸浮在四氯化碳中,分離產品的實驗方法利用過濾得到,故選:B;
(5)雙通玻璃管的作用是防止液體倒吸;濃硫酸起到吸收多余的氨氣,同時防止空氣中水蒸氣進入反應器使氨基甲酸銨水解,
故答案為:防止倒吸;吸收多余氨氣;
(6)取因部分變質而混有碳酸氫銨的氨基甲酸銨樣品7.82g,用足量石灰水充分處理后,使碳元素完全轉化為碳酸鈣,過濾、洗滌、干燥,測得質量為10.0g.物質的量為$\frac{10g}{100g/mol}$=0.1mol,設樣品中氨基甲酸銨物質的量為x,碳酸氫銨物質的量為y,由碳元素守恒可知,
x+y=0.1
78x+79y=7.82
解得x=0.08mol
y=0.02mol
則樣品中氨基甲酸銨的質量分數=$\frac{0.08mol×78g/mol}{7.82g}$×100%=79.8%,故答案為:79.8%.
點評 本題考查了物質制備實驗的設計應用,主要是氨氣的制備方法,氨基甲酸的制備實驗裝置分析判斷,實驗基本操作,混合物分離的實驗設計,有關混合物的計算,題目難度中等.


 小博士期末闖關100分系列答案
小博士期末闖關100分系列答案 名校名師培優作業本加核心試卷系列答案
名校名師培優作業本加核心試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | NH3是10電子分子,具有還原性 | B. | 液氨、氨氣、氨水是同一種物質 | ||
| C. | 氨氣是非電解質,氨水是電解質 | D. | NH3•H2O是混合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 正反應是吸熱反應,且A不是氣態 | B. | 正反應是放熱反應,且A不是氣態 | ||
| C. | 正反應是吸熱反應,且A是氣態 | D. | 正反應是放反應,且A是氣態 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:填空題
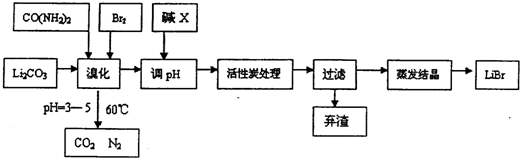
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 氫氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有在生物體內才能合成的物質 | B. | 有機物都是含有碳元素的化合物 | ||
| C. | 有機化合物都能燃燒 | D. | 含有碳元素的物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu$→_{v}^{O_{2}}$CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{結晶}{→}$CuSO4•5H2O | |
| B. | Al$→_{v}^{O_{2}}$Al2O3$\stackrel{{H}_{2}S{O}_{4}}{→}$Al2(SO4)3溶液$\stackrel{加熱蒸干}{→}$Al2(SO4)3 | |
| C. | FeSO4溶液$\stackrel{{H}_{2}S}{→}$FeS$→_{干燥}^{過濾}$FeS晶體 | |
| D. | MgCl2溶液$→_{過濾}^{NH_{3}}$Mg(OH)2$\stackrel{適量HN{O}_{3}}{→}$Mg(NO3)2溶液$\stackrel{結晶}{→}$Mg(NO3)•6H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com