
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 電離平衡常數(25℃) | Ka=1.77×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
分析 (1)相同條件下,弱酸的電離平衡常數越大,則弱酸的電離程度越大,其酸性越強;
(2)酸性越弱對應形成的鹽的水解能力越強,堿性越強;
(3)酸的電離常數越大,酸性越強,其鹽的水解程度越小;水解程度越大,溶液中酸根離子濃度越小;
(4)根據強酸制取弱酸判斷,H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-;
(5)甲酸為弱電解質,pH=3的甲酸和pH=11的氫氧化鈉溶液等體積混合,甲酸過量,溶液呈酸性,據此回答.
解答 解:(1)相同條件下,弱酸的電離平衡常數越大,則弱酸的電離程度越大,其酸性越強,即Ka值越大,酸性越強,故答案為:Ka值越大,酸性越強;
(2)圖表中比較得到酸性強弱H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-,對應鹽水解程度HSO3-<HCOO-<SO32-<HCO3-<ClO-<CO32-,室溫下①0.1mol•L-1 HCOONa,②0.1mol•L-1 NaClO,③0.1mol•L-1 Na2CO3,④0.1mol•L-1 NaHCO3溶液的pH由大到小的關系為:③②④①,
故答案為:③②④①;
(3)水解程度越大,溶液中酸根離子濃度越小,水解程度:CO32->SO32-,則溶液中離子濃度:SO32->CO32->HSO3->HCO3-;
故答案為:SO32->CO32->HSO3->HCO3-;
(4)根據強酸制取弱酸知,H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-,
a.次氯酸的酸性大于碳酸氫根離子而小于碳酸,所以次氯酸根離子和碳酸反應生成次氯酸和碳酸氫根離子,故a錯誤;
b.甲酸酸性大于碳酸,所以2HCOOH+CO32-→2HCOO-+H2O+CO2↑能發生,故b正確;
c.甲酸的酸性大于亞硫酸氫根離子而小于亞硫酸,所以亞硫酸和甲酸根離子反應生成甲酸和亞硫酸氫根離子,故c錯誤;
d.次氯酸的酸性大于碳酸氫根離子而小于鹽酸,如果碳酸鈉過量,發生的反應為Cl2+H2O+2CO32-→2HCO3-+Cl-+ClO-能發生,故d正確;
故答案為:bd;
(5)甲酸為弱電解質,pH=3的甲酸和pH=11的氫氧化鈉溶液等體積混合,甲酸過量,溶液呈酸性,則c(H+)>c(OH-),溶液中存在:c(HCOO-)+c(OH-)=c(Na+)+c(H+),則c(Na+)<c(HCOO-),離子濃度順序是:c(HCOO-)>c(Na+)>c(H+)>c(OH-).
故答案為:c(HCOO-)>c(Na+)>c(H+)>c(OH-).
點評 本題考查了鹽類水解、弱電解質的電離等知識點,根據弱電解質電離特點、鹽類水解特點來分析解答即可,注意把握電離常數與酸性強弱的關系,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 少量SO2 通入漂白粉溶液中:SO2+H2O+Ca2++3C1O-═CaSO4↓+2HC1O+Cl- | |
| B. | 石灰水與過量小蘇打溶液反應:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | FeCl2溶液中通入 C12:Fe2++Cl2═Fe3++2Cl- | |
| D. | NaAlO2 溶液中通入過量CO2:AlO2-+4CO2+2H2O═A13++4HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| t/℃ | 700 | 800 | 830 | 1 000 |
| K | 0.6 | 0.9 | 1.0 | 1.7 |
| A. | 上述生成CO和H2O的反應為放熱反應 | |
| B. | 加壓、增大H2濃度和加入催化劑都能提高CO2的轉化率 | |
| C. | 830℃達平衡后,再充入1.0 mol H2,K值增大,平衡正向移動 | |
| D. | 830℃時反應CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常數為1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 工業上,向500℃左右的鐵屑中通入Cl2生產無水氯化鐵,其制備過程中均要確保無水.現模擬該過程用圖示裝置進行實驗:
工業上,向500℃左右的鐵屑中通入Cl2生產無水氯化鐵,其制備過程中均要確保無水.現模擬該過程用圖示裝置進行實驗:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | pH=5的下列溶液(①NH4Cl溶液②CH3COOH溶液;③稀鹽酸)中由水電離出來的c(H+)水 ①>②>③ | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三種溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| D. | pH相同的下列三種溶液(①CH3COONa、②NaHCO3、③NaClO)中的c(Na+):①>②>③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2種 | B. | 3種 | C. | 4種 | D. | 5種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
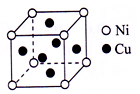 蘇州工匠用白銅打造的食蟹工具“蟹八件”,主要成分是銅鎳合金.Ni能與CO形成正四面體形的配合物Ni(CO)4,CuSO4溶于氨水形成SO4深藍色溶液.
蘇州工匠用白銅打造的食蟹工具“蟹八件”,主要成分是銅鎳合金.Ni能與CO形成正四面體形的配合物Ni(CO)4,CuSO4溶于氨水形成SO4深藍色溶液.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 28 g鐵粉與酸反應失去的電子數是NA | |
| B. | 標準狀況下,11.2 L NH3含有的原子總數為1.5NA | |
| C. | 0.5 mol•L-1 K2SO4溶液中所含K+的數目為NA | |
| D. | 46 g N02和N2O4的混合氣體含有的原子總數為3NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com