
 在1.0L密閉容器中放入0.10molA(g),在一定溫度進行如下反應:
在1.0L密閉容器中放入0.10molA(g),在一定溫度進行如下反應:| 時間t/h | 0 | 1 | 2 | 4 | 8 | 16 |
| 總壓強p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 8.54 |
| c(A)/(mol•L-1) | 0.10 | 0.086 | 0.071 | 0.051 | a | a |
分析 (1)G=△H-T△S,△G為自由能變化,△H為焓變,T為熱力學溫度,△S熵變,當△G<0時反應能自發進行,△G>0時反應不能自發進行,據此分析判斷;
(2)相同條件下壓強之比等于物質的量之比,反應前后物質的量的增大等于反應的A的物質的量,結合轉化率概念計算得到;
(3)化學平衡常數為生成物濃度系數次冪的乘積與反應物濃度系數次冪乘積的比值,Kp的表達式是將平衡分壓代替平衡濃度,某物質的平衡分壓=總壓×該物質的物質的量分數;
(4)同溫同壓下,壓強之比等于物質的量之比,根據A(g)?B(g)+C(g),反應前后增大的物質的量為反應的A的物質的量,結合表中壓強與物質的量的關系計算;
(5)升高溫度,正、逆反應速率均加快,正反應為吸熱反應,升高溫度,平衡向吸熱反應方向移動,正反應建立平衡,平衡時A的物質的量濃度減小,逆反應建立平衡,平衡時B、C的物質的量濃度增大.
解答 解:(1)反應自發進行需要滿足,△H-T△S<0,依據題干條件可知,A(g)?B(g)+C(g)△H=+285.1kJ•mol-1,正反應為氣體分子數增大的反應,△S>0,正反應吸熱,△H=+285.1kJ•mol-1>0,所以反應一定是在高溫條件下才能自發進行,
故答案為:高溫;
(2)反應前后氣體物質的量增大量等于反應的A的量,所以由總壓強p和起始壓強p0計算反應物A的轉化率α(A)的表達式=$\frac{P-{P}_{0}}{{P}_{0}}$×100%=($\frac{P}{{P}_{0}}$-1)×100%;
平衡時A的轉化率α(A)=($\frac{8.54}{4.91}$-1)×100%=73.9%,
故答案為:($\frac{P}{{P}_{0}}$-1)×100%;73.9;
(3)反應物A的轉化率α(A),A(g)?B(g)+C(g),
起始(mol/L):0.1 0 0
變化(mol/L):0.1α(A) 0.1α(A) 0.1α(A)
終了(mol/L):0.1-0.1α(A) 0.1α(A) 0.1α(A)
化學平衡常數為生成物濃度系數次冪的乘積與反應物濃度系數次冪乘積的比值,物質的平衡分壓=總壓×該物質的物質的量分數,所以平衡常數KP=$\frac{\frac{0.1α(A)}{[0.1+0.1α(A)]}p×\frac{0.1α(A)}{[0.1+0.1α(A)]}p}{\frac{0.1+0.1α(A)}{[0.1+0.1α(A)]}P}$=$\frac{{α}^{2}(A)}{[1+α(A)]×[1-α(A)]}P$,
故答案為:$\frac{{α}^{2}(A)}{[1+α(A)]×[1-α(A)]}P$;
(4)總壓強用P表示,起始壓強用P0表示,同溫同壓下,壓強之比等于物質的量之比,$\frac{{P}_{0}}{0.1}=\frac{P}{{n}_{總}}$,n總=0.1×$\frac{P}{{P}_{0}}$,A(g)?B(g)+C(g),反應過程中,n(A)消耗:n總=(P-P0):P,A物質的量n(A)=0.1-n(A)消耗=0.1-n總×$\frac{P-{P}_{0}}{P}$=0.1-0.1×$\frac{P}{{P}_{0}}$×$\frac{P-{P}_{0}}{P}$=0.1×(2-$\frac{P}{{P}_{0}}$)mol,總壓強P=8.54×100kPa時反應達到平衡狀態,P0=4.91×100KPa,A的轉化率α(A)的表達式=$\frac{P-{P}_{0}}{{P}_{0}}$×100%=$\frac{8.54-4.91}{4.91}$×100%;c(A)=$\frac{(0.1-0.1×\frac{8.54-4.91}{4.91})mol}{1L}$≈0.026mol/L,
故答案為:0.1×$\frac{P}{{P}_{0}}$;0.1×(2-$\frac{P}{{P}_{0}}$);c(A)=0.026mol/L;
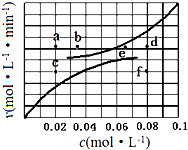
(5)對于A(g)?B(g)+C(g),△H=+285.1kJ•mol-1反應建立平衡時:升高溫度,正、逆反應速率均加快,因此排除C點,正反應為吸熱反應,升高溫度,平衡向吸熱反應方向移動,因此平衡正向移動,再次平衡時A的物質的量濃度減小,因此排除b點,故選a點;對于A(g)?B(g)+C(g),反應建立平衡時:升高溫度,正、逆反應速率均加快,升高溫度,平衡向吸熱反應方向移動,因此平衡逆向移動,再次平衡時B、C的物質的量濃度增大,故選d點,
故答案為:a、d.
點評 本題考查壓強關系和物質的量的計算應用,化學平衡計算方法,圖表數據處理方法的分析判斷,側重考查學生自學能力、分析解決問題的能力,注意表中數據為壓強關系和物質的量的關系,題目難度中等.


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:實驗題
| a | b | c | |
| Ⅰ | 干燥的有色布條 | 濕潤的有色布條 | 濕潤的有色布條 |
| Ⅱ | 堿石灰 | 濃硫酸 | 無水氯化鈣 |
| Ⅲ | 濕潤的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
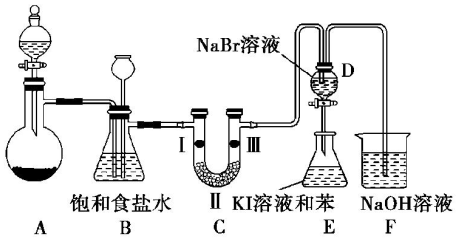
 .打開活塞,將 D中的少量溶液加入E中,振蕩E,觀察到E中溶液分為兩層,上層(苯層)為紫紅色.該現象不能( 填“能”或“不能”)說明Br2的氧化性大于I2.
.打開活塞,將 D中的少量溶液加入E中,振蕩E,觀察到E中溶液分為兩層,上層(苯層)為紫紅色.該現象不能( 填“能”或“不能”)說明Br2的氧化性大于I2.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 NO能引起光化學煙霧,破壞臭氧層.處理NO有多種方法,請根據題意回答下列問題:
NO能引起光化學煙霧,破壞臭氧層.處理NO有多種方法,請根據題意回答下列問題:| 時間(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 據報道,一定條件下 Fe2O3可被甲烷還原為“納米級”的金屬鐵.其反應為:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)
據報道,一定條件下 Fe2O3可被甲烷還原為“納米級”的金屬鐵.其反應為:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 容器編號 | 溫度/℃ | 起始物質的量/mol | 平衡物質的量/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| 容器Ⅰ | 300 | 0.3 | 0.1 | 0.02 | |
| 容器Ⅱ | 300 | 0.6 | 0.2 | ||
| 容器Ⅲ | 240 | 0.3 | 0.1 | 0.01 | |
| A. | 該反應正反應為吸熱反應 | |
| B. | 容器Ⅲ達到平衡的時間比容器I短 | |
| C. | 240℃時,該反應的平衡常數為1.08×104 | |
| D. | 容器Ⅱ達到平衡時SO2的轉化率比容器I小 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com