
 NO能引起光化學煙霧,破壞臭氧層.處理NO有多種方法,請根據題意回答下列問題:
NO能引起光化學煙霧,破壞臭氧層.處理NO有多種方法,請根據題意回答下列問題:| 時間(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
分析 Ⅰ.(1)根據表格中數據算出前2s內的平均反應速率υ(NO)=(1.00×10-3-1.70×10-4 )÷2=4.15×10-4mol/(L•s),根據化學反應速率之比等于化學計量數之比,υ(N2)=1/2υ(NO)=2.08×10-4 mol/(L•s);由表格數據看出第3s后c(NO)不變則達平衡,此時c(CO)=1.00×10-4mol•L-1,c(CO2)=1.00×10-3mol•L-1 -1.00×10-4mol•L-1=9.00×10-4mol•L-1,c(N2)=1/2c(CO2)=4.50×10-4mol•L-1,根據K=c(CO2)2×c(N2)/(c(NO)2×c(CO)2)=3.65×106,
(2)達到平衡時,要提高NO轉化率,即改變條件要使平衡正向移動,
A.選用更有效的催化劑,平衡不移動,故A錯誤;
B.降低反應體系的溫度,該反應為放熱反應,正向移動,故B正確;
C.充入氬氣使容器內壓強增大,平衡不移動,故C錯誤;
D.充入CO使容器內壓強增大,相當于增大CO濃度,平衡正向移動,NO轉化率提高,故D正確.
(3)由已知方程①2NO(g)+2CO(g)=2CO2(g)+N2(g)△H=-748kJ/mol及②N2(g)+O2(g)=2NO(g)△H=+180kJ/mol.根據蓋斯定律①÷2+②÷2得CO的燃燒熱的熱化學方程式為CO(g)+1/2O2(g)=CO2(g)△H=(-748kJ/mol)÷2+(+180kJ/mol)÷2=-284 kJ/mol;
Ⅱ.(4)O3氧化NO結合水洗可產生HNO3和O2,轉移電子數=化合價升高數,NO轉化為HNO3 ,化合價升高3,每生成1mol的HNO3轉移3mol電子
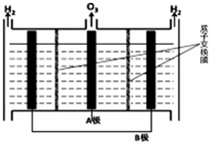
(5)根據已知圖,A極出來的是O3,B極出來的是H2,說明A極發生的氧化反應為陽極,B極發生還原反應為陰極,陽極(惰性電極)的電極反應式為3H2O-6e-=O3+6H+
解答 解:Ⅰ.(1)根據表格中數據算出前2s內的平均反應速率υ(NO)=(1.00×10-3-1.70×10-4 )÷2=4.15×10-4mol/(L•s),根據化學反應速率之比等于化學計量數之比,υ(N2)=1/2υ(NO)=2.08×10-4 mol/(L•s);由表格數據看出第3s后c(NO)不變則達平衡,此時c(CO)=1.00×10-4mol•L-1,c(CO2)=1.00×10-3mol•L-1 -1.00×10-4mol•L-1=9.00×10-4mol•L-1,c(N2)=1/2c(CO2)=4.50×10-4mol•L-1,根據K=c(CO2)2×c(N2)/(c(NO)2×c(CO)2)=3.65×106,
故答案為:2.08×10-4 mol/(L•s);3.65×106.
(2)達到平衡時,要提高NO轉化率,即改變條件要使平衡正向移動,
A.選用更有效的催化劑,平衡不移動,故A錯誤;
B.降低反應體系的溫度,該反應為放熱反應,正向移動,故B正確;
C.充入氬氣使容器內壓強增大,平衡不移動,故C錯誤;
D.充入CO使容器內壓強增大,相當于增大CO濃度,平衡正向移動,NO轉化率提高,故D正確.
故答案為:BD.
(3)由已知方程①2NO(g)+2CO(g)=2CO2(g)+N2(g)△H=-748kJ/mol,
②N2(g)+O2(g)=2NO(g)△H=+180kJ/mol.
根據蓋斯定律(①+②)×$\frac{1}{2}$得CO的燃燒熱的熱化學方程式為:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=(-748kJ/mol)×$\frac{1}{2}$+(+180kJ/mol)×$\frac{1}{2}$=-284 kJ/mol,
故答案為:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-284 kJ/mol;
Ⅱ.(4)O3氧化NO結合水洗可產生HNO3和O2,轉移電子數=化合價升高數,NO轉化為HNO3 ,化合價升高3,每生成1mol的HNO3轉移3mol電子,
故答案為:3;
(5)根據已知圖,A極出來的是O3,B極出來的是H2,說明A極發生的氧化反應為陽極,B極發生還原反應為陰極,陽極(惰性電極)的電極反應式為3H2O-6e-=O3+6H+,
故答案為:B;3H2O-6e-=O3+6H+.
點評 本題考查了反應速率、平衡常數、轉化率的計算,反應能量變化的分析判斷和熱化學方程式的書寫,化學平衡的影響因素分析應用,平衡常數計算,電極方程式的書寫等,掌握基礎是解題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10:1 | B. | 100:1 | C. | 1:100 | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ?
? (g)+H2(g)△H=+124kJ•mol-1
(g)+H2(g)△H=+124kJ•mol-1| 化學鍵 | C-H | C-C | C=C | H-H |
| 鍵能/kJ•mol-1 | 412 | 348 | x | 436 |
 +Cl2(g)?
+Cl2(g)? +HCl(g)△H2>0
+HCl(g)△H2>0
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在1.0L密閉容器中放入0.10molA(g),在一定溫度進行如下反應:
在1.0L密閉容器中放入0.10molA(g),在一定溫度進行如下反應:| 時間t/h | 0 | 1 | 2 | 4 | 8 | 16 |
| 總壓強p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 8.54 |
| c(A)/(mol•L-1) | 0.10 | 0.086 | 0.071 | 0.051 | a | a |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | m=-26.5 2c=a-b | B. | m=-53 c2=$\frac{a}{b}$ | C. | m=-26.5 c2=$\frac{a}{b}$ | D. | m=-53 2c=a-b |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向2.0mL濃度均為0.lmol•L-l的KC1、KI混合溶液中滴加1~2滴0.0lmol/LAgNO3溶液,振蕩,沉淀呈黃色,說明AgCl的Ksp比Agl的Ksp大 | |
| B. | 在稀硫酸中加入銅粉,銅粉不溶解;再加入適量的H2O2,銅粉仍不溶解 | |
| C. | 向AIC13溶液中滴加氨水,產生白色沉淀;再加入NaHSO4溶液,沉淀不消失 | |
| D. | 將CO2通入Ba(NO3)2溶液中至飽和,無沉淀產生;再通入SO2,也無沉淀產生 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com