
分析 (1)赤鐵礦的主要成分為氧化鐵,工業上用一氧化碳還原赤鐵礦冶煉鐵,同時生成二氧化碳,根據元素守恒書寫化學方程式;
(2)在氧化還原反應中元素化合價降低的作氧化劑,根據氧化還原反應方程中元素的化合價的變化等于轉移電子數目進行判斷;
(3)刻制印刷電路時,用FeCl3溶液與銅反應生成亞鐵離子和銅離子,根據電荷守恒和元素守恒書寫反應的離子方程;
解答 解:(1)赤鐵礦的主要成分為氧化鐵,化學式為Fe2O3,工業上用一氧化碳還原赤鐵礦冶煉鐵,同時生成二氧化碳,反應的化學方程式為Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 ,
故答案為:Fe2O3;Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 ;
(2)在反應14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,銅從+2價降為+1價,硫從-1價降為-2價,所以反應中氧化劑為CuSO4和FeS2,反應中化合價降低的總數為14×1+7×1=21,即當有5molFeS2發生反應時,電子轉移數為21mol,
故答案為:CuSO4和FeS2;21mol;
(3)刻制印刷電路時,用FeCl3溶液與銅反應生成亞鐵離子和銅離子,反應的離子方程為Cu+2Fe3+=2Fe2++Cu2+,
故答案為:Cu+2Fe3+=2Fe2++Cu2+.
點評 本題考查離子反應方程式的書寫、氧化還原反應分析等,為高考常見題型,把握發生的化學反應為解答的關鍵,側重氧化還原反應的考查,注意離子反應的書寫方法,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
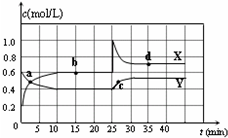 已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0.在恒溫條件下將一定量NO2和N2O4的混合氣體通入容積為2L的密閉容器中,反應物濃度隨時間變化關系如圖.下列說法正確的是( )
已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0.在恒溫條件下將一定量NO2和N2O4的混合氣體通入容積為2L的密閉容器中,反應物濃度隨時間變化關系如圖.下列說法正確的是( )| A. | 圖中Y曲線是表示NO2濃度隨時間的變化曲線 | |
| B. | 前10 min內v(N2O4)為0.1 mol/( L•min) | |
| C. | 25 min時,導致平衡移動的原因是將密閉容器的體積縮小為1L | |
| D. | 25 min時,導致平衡移動的原因是向容器通入適量NO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
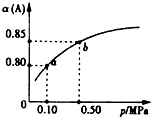 一定溫度下,向容積為1L的密閉容器中加入0.5molA和0.25molB,發生反應:2A(g)+B(g)?2C(?),達到平衡時,放出熱量Q1kJ.保持溫度不變,A的平衡轉化率(α)與體系總壓強(p)的關系如圖所示.則下列說法正確的是( )
一定溫度下,向容積為1L的密閉容器中加入0.5molA和0.25molB,發生反應:2A(g)+B(g)?2C(?),達到平衡時,放出熱量Q1kJ.保持溫度不變,A的平衡轉化率(α)與體系總壓強(p)的關系如圖所示.則下列說法正確的是( )| A. | 若容器內氣體的密度保持不變,說明反應一定達到平衡狀態 | |
| B. | 若在相同條件下,改為只加入0.5 mol C,則反應達到平衡反,放出熱量Q1kJ | |
| C. | 平衡狀態由a變到b時,則化學平衡常數K(a)=K(b) | |
| D. | 由圖象可知,產物C一定是氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合氣體密度 | B. | 容器內氣體的壓強 | ||
| C. | 混合氣體的平均相對分子質量 | D. | A的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知 H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,則 H2SO4和Ba(OH)2反應的反應熱△H=2×(-57.3)kJ•mol-1 | |
| B. | 葡萄糖的燃燒熱是2800 kJ•mol-1,則 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400kJ•mol-1 | |
| C. | H2(g)的燃燒熱是285.8 kJ•mol-1,則 2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 燃料電池中將甲醇蒸氣轉化為氫氣的熱化學方程式是 CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1,則 CH3OH(g)的燃燒熱為 192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 綠色化學的核心是應用化學原理對環境污染進行治理 | |
| B. | PM2.5表面積大,能吸附大量的有毒有害物質,對人的肺功能造成很大危害 | |
| C. | 二氧化硅廣泛應用于太陽能電池、計算機芯片 | |
| D. | 汽車尾氣中含有大量大氣污染物,這是汽油不完全燃燒造成的 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 共價鍵 | N≡N | H-H | N-H |
| 鍵能(kJ/mol) | 946 | 436 | 390.8 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com