
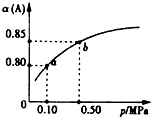
 一定溫度下,向容積為1L的密閉容器中加入0.5molA和0.25molB,發生反應:2A(g)+B(g)?2C(?),達到平衡時,放出熱量Q1kJ.保持溫度不變,A的平衡轉化率(α)與體系總壓強(p)的關系如圖所示.則下列說法正確的是( )
一定溫度下,向容積為1L的密閉容器中加入0.5molA和0.25molB,發生反應:2A(g)+B(g)?2C(?),達到平衡時,放出熱量Q1kJ.保持溫度不變,A的平衡轉化率(α)與體系總壓強(p)的關系如圖所示.則下列說法正確的是( )| A. | 若容器內氣體的密度保持不變,說明反應一定達到平衡狀態 | |
| B. | 若在相同條件下,改為只加入0.5 mol C,則反應達到平衡反,放出熱量Q1kJ | |
| C. | 平衡狀態由a變到b時,則化學平衡常數K(a)=K(b) | |
| D. | 由圖象可知,產物C一定是氣體 |
分析 A、因為C的狀態未確定,所以容器內氣體的質量不一定守恒,所以密度不能作為平衡狀態的判斷標志;
B、只加入0.5 mol C,反應向逆反應方向進行,該過程為吸熱反應;
C、平衡狀態由a變到b時,是壓強發生了變化,溫度不變,平衡常數只與溫度有關;
D、由圖象可知,增大壓強,A的轉化率增大,即平衡向正反應方向移動,在反應方程中,無論C的什么狀態,反應物氣體的計量數都大于產物,所以C不一定是氣體;
解答 解:A、如果C是氣態,容器內氣體的質量守恒,反應過程中密度始終不變,則密度不能作為平衡狀態的判斷標志,故A錯誤;
B、只加入0.5 mol C,反應向逆反應方向進行,該過程為吸熱反應,故B錯誤;
C、平衡狀態由a變到b時,是壓強發生了變化,溫度不變,平衡常數只與溫度有關,所以K(a)=K(b),故C正確;
D、由圖象可知,增大壓強,A的轉化率增大,即平衡向正反應方向移動,在反應方程中,無論C的什么狀態,反應物氣體的計量數都大于產物,所以C不一定是氣體,故D錯誤;
故選C.
點評 本題考查了平衡狀態的判斷,反應放出熱量的比較,影響平衡常數的因素等,題目綜合性較強,難度中等.


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| 選項 | 純凈物 | 混合物 | 強電解質 | 弱電解質 | 非電解質 |
| A | 食醋 | 膽礬晶體 | 純堿 | 小蘇打 | HD |
| B | 青銅 | 水煤氣 | 硝酸 | 硫化氫 | 乙醇 |
| C | 燒堿 | 水玻璃 | 硫酸鋇 | 一水合氨 | 液氨 |
| D | C12H22O11 | 鋁熱劑 | 三氧化硫 | 二氧化硫 | 二氧化硅 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,反應物總能量<生成物總能量 | |
| B. | 相同條件下,1mol氫原子所具有的能量為E1,1mol氫分子的能量為E2,則2E1>E2 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,H2的燃燒熱為241.8kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,含1molNaOH的NaOH溶液與含0.5molH2SO4的濃硫酸混合后放出57.3kJ的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
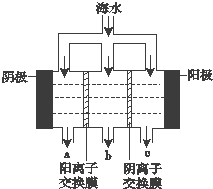 《科學》曾評出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一種重要的自然資源,是人類賴以生存不可缺少的物質.水質優劣直接影響人體健康.海洋是化學資源寶庫,海洋資源的綜合利用具有廣闊的前景.人類把海水淡化,就可以得到大量的飲用水,常規蒸餾法,技術和工藝比較完備,但也存在較大缺陷,大量推廣離子交換法和電滲析法.
《科學》曾評出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一種重要的自然資源,是人類賴以生存不可缺少的物質.水質優劣直接影響人體健康.海洋是化學資源寶庫,海洋資源的綜合利用具有廣闊的前景.人類把海水淡化,就可以得到大量的飲用水,常規蒸餾法,技術和工藝比較完備,但也存在較大缺陷,大量推廣離子交換法和電滲析法.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
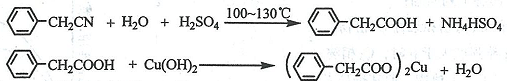
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com