
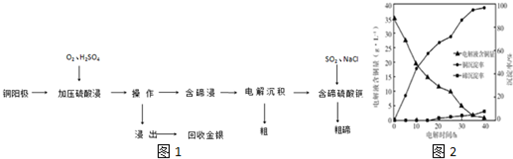
分析 (1)①Ag2Te也能與O2發生類似Cu2Te的反應,結合Cu2Te與氧氣反應的特點書寫;
②工業上一般用壓縮機加壓給原料氣加壓;
(2)操作Ⅰ用于分離固體和液體;
(3)由操作Ⅰ可知分離出Ag、Au,則“含碲浸出液”的溶質含有TeOSO4、CuSO4;
(4)電解液含銅量逐漸減小,電解初始階段陰極應生成銅;
(5)①TeOSO4與二氧化硫發生氧化還原反應生成Te;
②NaCl資源豐富,價格便宜;
③根據Te(IV)的濃度的變化計算還原率.
解答 解:(1)①Ag2Te也能與O2發生類似Cu2Te的反應,則與氧氣反應生成Ag2O和TeO2,反應的化學方程式為2Ag2Te+3O2=2Ag2O+2TeO2,
故答案為:2Ag2Te+3O2=2Ag2O+2TeO2;
②工業上一般用壓縮機加壓給原料氣加壓,
故答案為:用壓縮機加壓;
(2)操作Ⅰ用于分離固體和液體,為過濾操作,
故答案為:過濾;
(3)由操作Ⅰ可知分離出Ag、Au,則“含碲浸出液”的溶質含有TeOSO4、CuSO4,
故答案為:CuSO4;
(4)電解液含銅量逐漸減小,電解初始階段陰極應生成銅,電極方程式為Cu2++2e-=Cu,
故答案為:Cu2++2e-=Cu;
(5)①TeOSO4與二氧化硫發生氧化還原反應生成Te,反應的化學方程式為TeOSO4+2SO2+3H2O=Te+3H2SO4,
故答案為:TeOSO4+2SO2+3H2O=Te+3H2SO4;
②NaCl比KI的資源豐富,價格便宜,所以工業生產時更節約成本,
故答案為:NaCl比KI價格便宜;
③Te(IV)濃度從6.72g•L-1下降到0.10g•L-1,Te(IV)的還原率為:$\frac{6.72-0.10}{6.72}$=98.5%,
故答案為:98.5%.
點評 本題為生產流程題,為高考常見題型和高頻考點,題目難度中等,涉及金屬的回收、氧化還原反應、物質的分離提純和除雜,側重于學生的分析、計算能力的考查,題目較為綜合,做題時注意仔細審題,從題目中獲取關鍵信息,試題培養了學生的分析、理解能力及化學實驗能力.


科目:高中化學 來源: 題型:選擇題
| A. | 某試樣焰色反應呈黃色,則試樣中含有K+ | |
| B. | 廣泛pH試紙測得某堿性溶液的pH為12.5 | |
| C. | 容量瓶不能用作溶解物質的容器 | |
| D. | 粗鹽的提純試驗中,濾液在坩堝中加熱蒸發結晶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol FeCl3 水解生成的Fe(OH)3膠粒數為lNA | |
| B. | 4.6g有機物C2H6O的分子結構中含有的C一H鍵數目一定為0.5NA | |
| C. | 標準狀況下,11.2 L CO2 與足量Na2O2反應轉移的電子數為0.5NA | |
| D. | 1 mol/L AlCl3溶液中含有3NA個Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗方案 | 實驗目的或結論 |
| A | 取一個小木條,放入飽和硅酸鈉溶液中,充分吸濕、浸透,取出稍瀝干后,置于酒精燈外焰處,木條未燃燒 | 證明硅酸鈉可作木材防火劑 |
| B | 向取好未知濃度氫氧化鈉溶液的錐形瓶中加入2mL酚酞,然后進行正確滴定,最后一滴鹽酸滴入,溶液由紅色變為無色且半分鐘不恢復 | 準確判斷已知濃度的鹽酸滴定未知濃度的氫氧化鈉溶液的滴定的終點 |
| C | 向裝有石灰石的簡易啟普發生器中加入濃醋酸,將產生的氣體先通入飽和碳酸氫鈉溶液,再通入苯酚鈉溶液中,苯酚鈉溶液產生渾濁 | 酸性:醋酸>碳酸>苯酚 |
| D | 向盛有苯酚的濃溶液的試管里逐滴加入稀溴水,邊滴邊振蕩 | 苯酚的定性檢驗 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Y>X,離子半徑Z<W | |
| B. | 元素Y的單質能與元素X的最高價氧化物發生置換反應 | |
| C. | 元素Y和W能形成YW2型離子化合物 | |
| D. | W的單質有毒,能使濕潤的有色布條褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,7.8 gNa2S和Na2O2的混合物中,陰離子所含電子數為1.8NA | |
| B. | 標準狀況下,11.2 L 二氯甲烷中含有的分子數目為0.5NA | |
| C. | 常溫常壓下,28 g乙烯與丙烯的混合氣體含有的碳原子數目無法計算 | |
| D. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+數目小于0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 18 g冰的晶體中含有氫鍵的數目為2 NA | |
| B. | 11.2 L丙烷(標準狀況)中含有σ鍵的數目為5NA | |
| C. | 2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的數目為2NA | |
| D. | 1 mol C12與足量NaOH溶液反應,轉移電子的數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com