
分析 I.(1)基態(tài)N原子中電子在2p軌道上的排布遵循的原則是洪特規(guī)則,N2F2分子中N原子之間形成N=N雙鍵,N原子與F原子之間形成N-F鍵,N原子含有1對孤對電子;
(2)Si3N4晶體中Si原子周圍有4個N原子,Si原子為sp3雜化,N原子周圍連接3個Si原子,含有1對孤對電子,N原子為sp3雜化,但孤對電子對成鍵電子對的排斥作用更大;
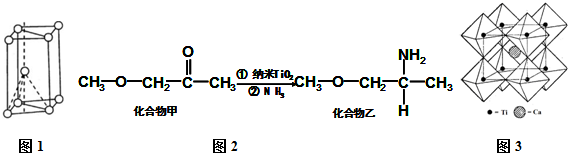
II.(1)核外電子沒有運動狀態(tài)相同的電子;由金屬鈦晶胞結構可知,屬于六方最密堆積;
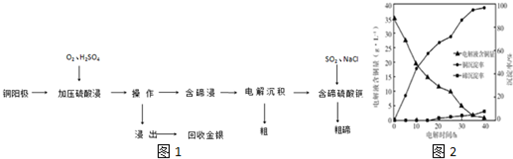
(2)化合物甲與化合物乙均為分子晶體,但化合物乙分子間可形成氫鍵;化合物乙中C、N、O三種原子的雜化軌道形成均為sp3,同周期自左而右電負性增大;
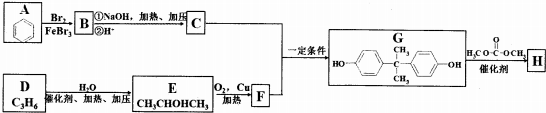
(3)鈦晶礦晶胞中鈦離子與周圍六個氧原子包圍形成八面體,立方體晶胞共有12個邊長,每條邊長的中點是一個氧原子,共12個氧原子包圍著中心的鈣離子,根據均攤法計算圖中立方體中各原子數目確定化學式;
若氧離子半徑為a pm,則正八面體的棱長為2a pm,則2個正四面體的連接面為正方形,該正方形棱長為2a pm,Ti位于正方形的中心,兩個鈦離子間最短距離等于正方形對角線長度,圖中立方體中心鈣離子與頂點上鈦離子之間距離最短,為體對角線長度的$\frac{1}{2}$.
解答 解:(1)基態(tài)N原子中電子在2p軌道上的排布遵循的原則是洪特規(guī)則,
N2F2分子結構式為F-N=N-F,分子中N原子含有1對孤對電子,N原子的雜化方式是sp2雜化,l mol N2F2含有3molσ鍵,
故答案為:洪特規(guī)則;sp2雜化;3;
(2)Si3N4晶體中Si原子周圍有4個N原子,Si原子為sp3雜化,N-Si-N鍵角為109°28′,N原子周圍連接3個Si原子,含有1對孤對電子,N原子為sp3雜化,但孤對電子對成鍵電子對的排斥作用更大,使得Si-N-Si鍵角小于109°28′,
故答案為:>;Si3N4晶體中Si原子周圍有4個N原子,Si原子為sp3雜化,N-Si-N鍵角為109°28′,N原子周圍連接3個Si原子,含有1對孤對電子,N原子為sp3雜化,但孤對電子對成鍵電子對的排斥作用更大,使得Si-N-Si鍵角小于109°28′;
Ⅱ(1)Ti原子核外電子數為22,核外共有22種運動狀態(tài)不相同的電子;由金屬鈦晶胞結構可知,屬于六方最密堆積;
故答案為:22;六方最密;
(2)化合物乙因分子間存在氫鍵,則化合物乙的沸點比化合物甲高,化合物乙中C、N、O三種原子的雜化軌道形成均為sp3,同周期自左而右電負性增大,故電負性:O>N>C,
故答案為:化合物乙分子間形成氫鍵;O>N>C;
(3)鈦離子位于立方晶胞的角頂,被6個氧離子包圍成配位八面體;鈣離子位于立方晶胞的體心,被12個氧離子包圍;每個晶胞中鈦離子和鈣離子均為1個,晶胞的12個邊長上各有一個氧原子,根據均攤原則,每個晶胞實際占有氧原子數目為12×$\frac{1}{4}$=3,則晶胞的化學式為CaTiO3,
若氧離子半徑為a pm,則正八面體的棱長為2a pm,則2個正四面體的連接面為正方形,該正方形棱長為2a pm,Ti位于正方形的中心,兩個鈦離子間最短距離正方形對角線長度,故兩個鈦離子間最短距離為2$\sqrt{2}$a pm,圖中立方體中心鈣離子與頂點上鈦離子之間距離最短,為體對角線長度的$\frac{1}{2}$,則二者最短距離為$\frac{1}{2}$×$\sqrt{3}$×2$\sqrt{2}$a pm=$\sqrt{6}$a pm,
故答案為:6;12;CaTiO3;2$\sqrt{2}$a;$\sqrt{6}$a.
點評 本題是對物質結構的考查,涉及核外電子排布、雜化軌道與空間構型、化學鍵、氫鍵、電負性、晶胞結構與計算等,Ⅱ(3)中晶胞結構與計算為易錯點、難點,需要顯示具備一定的空間想象與數學計算能力.


 陽光試卷單元測試卷系列答案
陽光試卷單元測試卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 +2ROH$\stackrel{催化劑}{→}$
+2ROH$\stackrel{催化劑}{→}$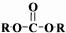 +2CH3CHOH(R為烴基)
+2CH3CHOH(R為烴基)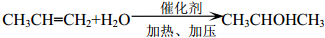 .
.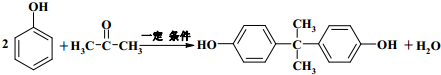 .
.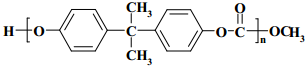 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
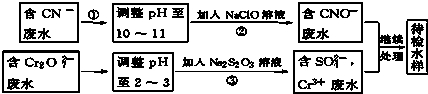
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
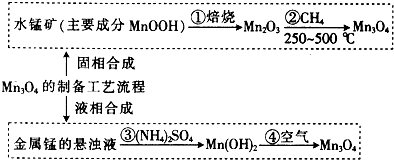
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
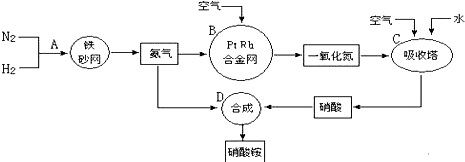
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


 ;D的核磁共振氫譜共有3組峰.
;D的核磁共振氫譜共有3組峰.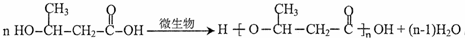 .
. 的合成路線圖為
的合成路線圖為 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com