
| A. | -(a-b)kJ•mol-1 | B. | -(a+b)kJ•mol-1 | ||
| C. | -(5a-0.5b)kJ•mol-1 | D. | -(0.5a-5b)kJ•mol-1 |
分析 碳在氧氣中燃燒,氧氣不足發生反應2C+O2$\frac{\underline{\;點燃\;}}{\;}$2CO,氧氣足量發生反應C+O2$\frac{\underline{\;點燃\;}}{\;}$CO2;3mol碳在2mol氧氣中燃燒,n(C):n(O2)=3:2,介于2:1與1:1之間,所以上述反應都發生.令生成的CO為xmol,CO2為ymol,根據碳元素與氧元素守恒列方程計算x、y的值,計算生成ymol二氧化碳方程的熱量,放出的總熱量減去生成二氧化碳放出的熱量為生成xmolCO放出的熱量,據此計算1molC與O2反應生成CO的反應熱△H.
解答 解:碳在氧氣中燃燒,氧氣不足發生反應2C+O2$\frac{\underline{\;點燃\;}}{\;}$2CO,氧氣足量發生反應C+O2$\frac{\underline{\;點燃\;}}{\;}$CO2;
3mol碳在2mol氧氣中燃燒,n(C):n(O2)=3:2,介于2:1與1:1之間,
設生成的CO為xmol,CO2為ymol,
根據碳元素守恒有x+y=3,根據氧元素守恒有x+2y=2×2,聯立方程解得:x=2,y=1,
0.1mol碳完全燃燒,放出熱量為 b kJ,則1mol碳完全燃燒,放出熱量為10b kJ,
所以生成1molCO放出的熱量為0.5×(akJ-10bkJ).
由于碳燃燒為放熱反應,所以反應熱△H的符號為“-”,
故1mol C與O2反應生成CO的反應熱△H=-0.5×(akJ-10bkJ)=-(0.5a-5b) kJ•mol-1,
故選D.
點評 本題考查反應熱的計算,題目難度不大,判斷碳與氧氣反應產物中一氧化碳與二氧化碳的物質的量是關鍵,注意反應熱△H的單位與符號,試題培養了學生的化學計算能力.


科目:高中化學 來源: 題型:解答題

 (不考慮空間構型,如有配位鍵,請標出)
(不考慮空間構型,如有配位鍵,請標出)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
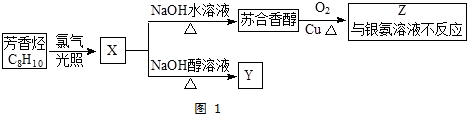
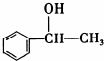 ,它不能發生的有機反應類型有④、⑥.
,它不能發生的有機反應類型有④、⑥.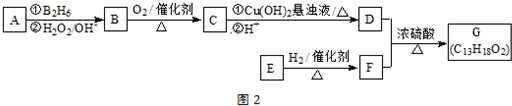
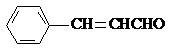 .
.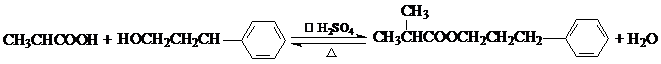 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 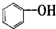 屬于醇類化合物 屬于醇類化合物 | B. | 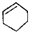 屬于芳香族化合物 屬于芳香族化合物 | ||
| C. | 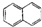 屬于脂環化合物 屬于脂環化合物 | D. | CH3CH(CH3)2屬于鏈狀化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 辛烯和3-甲基-1-丁烯 | B. | 甲苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 甲基環己烷和己烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
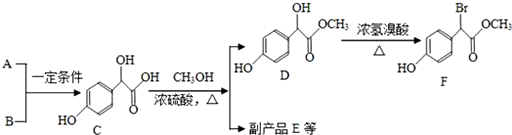
 .
.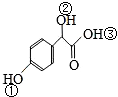 中①、②、③3個-OH的酸性有強到弱的順序是:③>①>②.
中①、②、③3個-OH的酸性有強到弱的順序是:③>①>②.
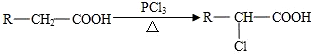
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 人類利用能源的三個階段分別是:柴草時期、化石能源時期、多能源結構時期 | |
| B. | 人類使用沼氣是對化學能的充分利用 | |
| C. | 發展低碳經濟、循環經濟,開發推廣太陽能、水能、風能等能源,減少煤、石油等化石燃料的使用 | |
| D. | 生物質能主要指用樹木、莊稼、草類等植物直接或間接提供的能量,它是不可再生的能源 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com