
| 步驟編號 | 操作過程 | 實驗現象 | 實驗結論 |
| ① | 氯水有酸性 | ||
| ② | 氯水有漂白性 | ||
| ③ | 氯水中存在Cl- |
分析 本實驗為氯氣的性質實驗,都是的在試管內完成,用到的主要儀器為試管及膠頭滴管,依據實驗目的選擇需要的藥品,驗證酸性可以用滴有酚酞的氫氧化鈉溶液,驗證氯水的漂白性,可以選擇品紅溶液,驗證氯離子,應先加硝酸排除雜質離子的干擾,然后加入硝酸銀,據此解答.
解答 解:本實驗為氯氣的性質實驗,都是的在試管內完成,用到的主要儀器為試管及膠頭滴管;
依據實驗目的選擇需要的藥品,驗證酸性可以用滴有酚酞的氫氧化鈉溶液,驗證氯水的漂白性,可以選擇品紅溶液,驗證氯離子,應先加硝酸排除雜質離子的干擾,然后加入硝酸銀,所以用到的藥品有:品紅溶液、硝酸銀溶液、稀硝酸;
驗證酸性可以向滴有酚酞的氫氧化鈉溶液的試管中加入新制的飽和氯水,然后振蕩,溶液由紅色變為無色,即可證明氯水有酸性;
驗證氯水的漂白性,可以選擇品紅溶液,向盛有品紅溶液的試管中加入新制的飽和氯水,若溶液由紅色變為無色,可證明氯水有漂白性;
驗證氯離子,應取少量的新制飽和氯水于試管 中,滴入幾滴硝酸銀溶液,若產生白色沉淀,然后加入硝酸,白色沉淀不消失,即可證明氯水中含有氯離子;
若步驟①中使用了滴有酚酞的氫氧化鈉溶液,溶液紅色褪色,有兩種可能原因:一是氯水中的酸中和了氫氧化鈉溶液,此時酚酞并未發生改變,二是氯氣與水生成的次氯酸氧化酚酞破壞了酚酞的結構而褪色.顯然,只要證明溶液中是否含有酚酞,就能確定是那種原因,可以向褪色的溶液中再滴入一滴氫氧化鈉溶液,若又顯紅色說明是因為中和而褪色,若無紅色出現說明是因氧化而褪色;
故答案為:
實驗用品:試管、膠頭滴管
選用試劑:品紅溶液、硝酸銀溶液、稀硝酸;
實驗記錄表:
| 步驟編號 | 操作過程 | 實驗現象 | 實驗結論 |
| ① | 取少量滴有酚酞的氫氧化鈉溶液于試管中,加入新制的飽和氯水,然后振蕩 | 溶液由紅色變為無色 | 氯水有酸性 |
| ② | 向少量盛有品紅溶液的試管中加入新制的飽和氯水,振蕩 | 溶液由紅色變為無色 | 氯水有漂白性 |
| ③ | 取少量的新制飽和氯水于試管 中,滴入幾滴硝酸銀溶液,再滴加稀硝酸 | 有白色沉淀產生 | 氯水中存在Cl- |
點評 本題考查了氯水性質探究實驗設計,明確實驗目的及氯氣、次氯酸性質是解題關鍵,注意實驗設計的嚴密性,題目難度不大.


 口算題卡河北少年兒童出版社系列答案
口算題卡河北少年兒童出版社系列答案 A加金題 系列答案
A加金題 系列答案 全優測試卷系列答案
全優測試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,則△H1<△H2 | |
| B. | C(石墨,s)=C(金剛石,s)△H=+1.9 kJ•mol-1,則金剛石比石墨穩定 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,則含20 g NaOH的稀溶液與稀醋酸恰好完全反應,放出的熱量為28.7 kJ | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,則碳的燃燒熱等于110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 裝置甲中銅片表面產生氣泡 | |
| B. | 裝置甲溶液中SO42ˉ向銅片做定向移動 | |
| C. | 裝置乙中電子從銅片經導線流向鋅片 | |
| D. | 裝置乙中正極的電極反應式:2H++2eˉ═H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
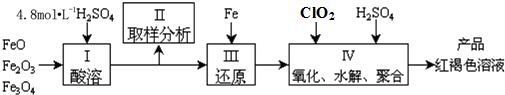
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
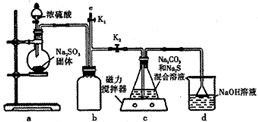 天津港“8.12”爆炸事故中,因爆炸沖擊導致氰化鈉泄漏,可以通過噴灑雙氧水或硫代硫酸鈉溶液來處理,以減輕污染.
天津港“8.12”爆炸事故中,因爆炸沖擊導致氰化鈉泄漏,可以通過噴灑雙氧水或硫代硫酸鈉溶液來處理,以減輕污染.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 開始沉淀時 | 3.4 | 6.3 | 1.5 |
| 完全沉淀時 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
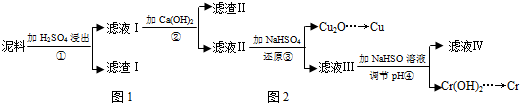
| Fe3+ | Cu2+ | Cr3+ | |
| 開始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
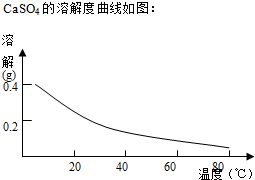
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 飽和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | $\frac{K_W}{{c({H^+})}}$=10-13mol•L-1溶液中:NH4+、Mg2+、NO3-、SO32- | |
| C. | 通入大量CO2的溶液中:Na+、SO32-、CH3COO-、HCO3- | |
| D. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com