
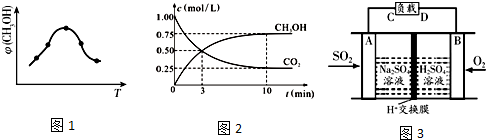
分析 (1)依據熱化學方程式和蓋斯定律計算得到;
(2)①由圖可知,到達平衡后,溫度越高,φ(CH3OH)越小,平衡向逆反應進行;化學平衡常數為生成物濃度系數次冪的乘積與反應物濃度系數次冪乘積的比值;
②先根據圖表,利用v=$\frac{△c}{△t}$計算v(CO2),再利用各物質的反應速率之比等于計量數之比,確定v(H2);到達平衡后,溫度越高,φ(CH3OH)越小,平衡向逆反應進行;
(3)①SO2與O2反應生成SO3,SO3再與水化合生成硫酸,根據硫酸的出口判斷正負極,負極發生氧化反應,正極發生還原反應;
②硝酸銨溶液中滴加適量的NaOH溶液溶液的pH=7,則氫離子和氫氧根離子濃度相等,根據電荷守恒來計算.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由蓋斯定律(①+②)×$\frac{1}{2}$得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol,
故答案為:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①由圖可知最高點反應到達平衡,達平衡后,溫度越高,φ(CH3OH)越小,平衡向逆反應進行,升高溫度平衡吸熱方向進行,逆反應為吸熱反應,則正反應為放熱反應,即△H3<0,化學平衡常數為生成物濃度系數次冪的乘積與反應物濃度系數次冪乘積的比值,則化學平衡常數為K=$\frac{C(C{H}_{3}OH)×C({H}_{2}O)}{C(C{O}_{2}){C}^{3}({H}_{2})}$,
故答案為:<;$\frac{C(C{H}_{3}OH)×C({H}_{2}O)}{C(C{O}_{2}){C}^{3}({H}_{2})}$;
②由圖可知,10min時,反應已經達平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,所以10min內,v(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),反應速率之比等于計量數之比,故v(H2)=3v(CO2)=3×0.075mol/(L•min)=0.225mol/(L•min),第10min后,向該容器中再充入1mol CO2和3mol H2,等效為增大壓強,平衡向正反應移動,CH3OH(g)的體積分數增大,
故答案為:0.225;變大;
(3)①該原電池中,負極上失電子被氧化,所以負極上投放的氣體是二氧化硫,二氧化硫失電子和水反應生成硫酸根離子和氫離子,則A為負極,A電極發生的反應為:SO2-2e-+2 H2O=4H++SO42-,
故答案為:SO2-2e-+2H2O=4H++SO42-;
②常溫下,向一定物質的量濃度的硝酸銨溶液中滴加適量的氨水溶液,使溶液中的NO3-和NH4+的物質的量濃度相等,溶液中電荷守恒c(H+)+c(NH4+)=c(NO3-)+c(OH-),c(H+)=c(OH-),溶液的pH=7,
故答案為:=.
點評 本題考查較為全面,涉及熱化學方程式的計算、化學平衡常數表達式的書寫、電化學知識等知識,為高考高頻考點,掌握反應熱計算的方法、電化學原理尤為重要,題目難度中等.


科目:高中化學 來源: 題型:選擇題
 將潔凈的三種金屬片X、Y和Z分別放置在浸有食鹽溶液的濾紙上并壓緊(如圖).每次實驗時,電壓表指針的偏移方向和讀數如下表.已知構成兩電極的金屬,活潑性相差越大,則電壓越大.對X、Y、Z和銅四種金屬的下列說法,不正確的是( )
將潔凈的三種金屬片X、Y和Z分別放置在浸有食鹽溶液的濾紙上并壓緊(如圖).每次實驗時,電壓表指針的偏移方向和讀數如下表.已知構成兩電極的金屬,活潑性相差越大,則電壓越大.對X、Y、Z和銅四種金屬的下列說法,不正確的是( )| 金屬片 | 電子流向 | 電壓(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A. | Z金屬可作為犧牲陽極保護法的陽極,保護Y金屬 | |
| B. | Y金屬不能從硫酸溶液中置換出氫氣 | |
| C. | 三種金屬的活潑性順序為:Y>X>Z | |
| D. | Z和Y能構成電壓最大的原電池 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固體,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$減小 | |
| C. | 升高溫度,平衡常數減小 | |
| D. | 通入CO2,溶液pH增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 精煉銅時粗銅做陰極,純銅做陽極 | |
| B. | 電解MgCl2飽和溶液,可制得金屬鎂 | |
| C. | 鋼鐵的腐蝕通常為電化學腐蝕,該腐蝕過程中負極反應為:Fe-3e-═Fe3+ | |
| D. | 氯堿工業和金屬鈉的冶煉都用到了NaCl,陽極反應都是:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石油、煤、天然氣、油脂都屬于化石燃料 | |
| B. | 油脂在堿性條件下的水解反應又稱為皂化反應 | |
| C. | 分子式為(C6H10O5)n的淀粉和纖維素互為同分異構 | |
| D. | 蔗糖是還原性糖 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 17g NH3所含的電子數是 10NA | |
| B. | 常溫常壓下,22.4L氧氣含氧原子數為2NA | |
| C. | 5.6g鐵粉與足量Cl2反應,失去的電子數為0.2NA | |
| D. | 2.3g金屬鈉全部變成鈉離子時失去的電子數是0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
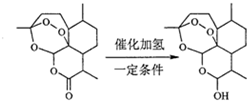
| A. | 青蒿素分子中治療瘧疾的活性基團是過氧基 | |
| B. | 雙氫青蒿素分子比青蒿素分子多1個手性碳原子 | |
| C. | 理論上每摩爾青蒿素水解需要消耗1molNaOH | |
| D. | 每摩爾雙氫青蒿素可以與1molNaHCO3反應生成1molCO2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com