
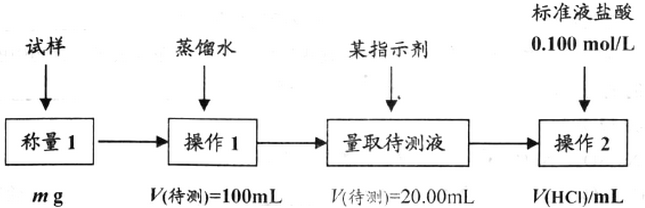
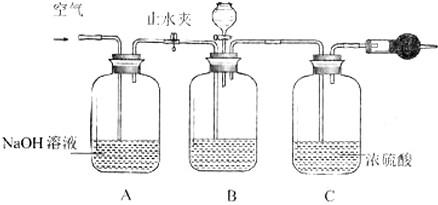
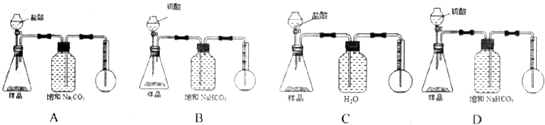
分析 (1)根據天平的感量確定稱量儀器,當前后兩次稱量的質量差不超過0.001g時說明已經達到恒重;
(2)根據一定物質的量濃度溶液的配制步驟選取實驗儀器;
(3)甲基橙的變色范圍是3.1-4.4,碳酸鈉溶液呈堿性,所以滴有甲基橙的碳酸鈉溶液呈黃色,當滴定終點時,溶液黃色恰好變成橙色;
(4)為減少誤差,應多做幾次實驗取平均值;
(5)能影響溶質物質的量的因素影響測定結果,否則不影響測定結果;
(6)方案三根據二氧化碳和碳酸鈉的關系式計算其質量分數;
(7)空氣中的水蒸氣會進入干燥管導致二氧化碳的質量偏大;在干燥管后加一裝有堿石灰的干燥管,吸收空氣中的水和二氧化碳;
(8)用排溶液的方法測量氣體體積,導管應該是“短進長出”,且所用溶液不能和二氧化碳反應.
解答 解:(1)方案一 托盤天平的過量是0.1g,電子天平的感量是0.001g,所以稱量藥品時用電子天平,當前后兩次稱量的質量差不超過0.001g時說明已經達到恒重,
故答案為:電子天平;前后兩次稱量的質量差不超過0.001g;
(2)方案二①配制一定物質的量濃度溶液時,用燒杯溶解固體藥品,用玻璃棒攪拌固體溶解和引流溶液,用容量瓶配制溶液,用膠頭滴管定容,
故答案為:燒杯、玻璃棒、100mL容量瓶、膠頭滴管;
(3)甲基橙的變色范圍是3.1-4.4,碳酸鈉溶液呈堿性,所以滴有甲基橙的碳酸鈉溶液呈黃色,當滴定終點時,溶液呈酸性,溶液黃色恰好變成橙色,且半分鐘內不褪色,
故答案為:黃色恰好變成橙色,且半分鐘內不褪色;
(4)為減少誤差,應多做幾次實驗取平均值,即做2-3次平行實驗,
故答案為:做2-3次平行實驗;
(5)滴定時若錐形瓶內有少量液體濺出,導致錐形瓶內溶液中溶質減少,所以測定結果偏低,若盛裝未知液的錐形瓶用蒸餾水洗過,未用未知液潤洗,對錐形瓶內溶液中的溶質無影響,所以測定結果無影響,
故答案為:偏低;無影響;
(6)堿石灰吸收的物質是二氧化碳,二氧化碳的質量是(W2-W1)g,根據碳原子守恒得碳酸鈉的質量=$\frac{106({m}_{2}-{m}_{1})}{44}$,
則純堿的質量分數=$\frac{53({m}_{2}-{m}_{1})}{22a}$;
故答案為:$\frac{53({m}_{2}-{m}_{1})}{22a}$;
(7)空氣中的水蒸氣會進入干燥管導致二氧化碳的質量偏大,則碳酸鈉的質量偏大,計算結果偏高;空氣中的水蒸氣進入干燥管而影響二氧化碳的測定,為防止水蒸氣的干擾,應該在干燥管右邊再加一個裝有堿石灰的干燥管,
故答案為:偏高;在干燥管右邊再加一個裝有堿石灰的干燥管;
(8)用排溶液的方法測量氣體體積,導管應該是“短進長出”,即進氣管長度小于出液管長度,且所用溶液不能和二氧化碳反應,碳酸氫鈉中含有碳酸氫根離子能抑制二氧化碳的溶解,
故答案為:D.
點評 本題主要考查了物質含量測定方法,掌握實驗原理是解題的關鍵,需要注意的是二氧化碳和水蒸氣對二氧化碳的測定有影響,所以為防止干擾要先除去空氣中二氧化碳和水蒸氣,為易錯點.


科目:高中化學 來源: 題型:選擇題
| A. | 方案Ⅱ比方案Ⅰ操作簡便 | |
| B. | 等質量的鋅,相同條件下方案Ⅰ和方案Ⅱ中制得的銅的質量相同 | |
| C. | 等質量的H2SO4參加反應,方案Ⅰ制取銅的質量比方案Ⅱ的少 | |
| D. | 為了加快鋅與稀硫酸反應,可以在溶液中加入少量氧化銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Y2X和Y2X2中化學鍵類型相同,陰、陽離子的個數比相同 | |
| B. | 氣態氫化物的熱穩定性:M>N | |
| C. | M與X的化合物對應的水化物一定是強酸 | |
| D. | 離子半徑r:r(X2-)>(r+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C$\stackrel{在空氣中點燃}{→}$CO$\stackrel{CuO,△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$Cu(OH)2 | |
| C. | Fe$\stackrel{點燃}{→}$Fe2O3$\stackrel{H_{2}SO_{4}溶液}{→}$Fe2(SO4)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}}{→}$NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;水楊酸與小蘇打溶液反應的化學方程式:
;水楊酸與小蘇打溶液反應的化學方程式: ; 一定條件下,C與F反應的反應類型是_酯化反應.
; 一定條件下,C與F反應的反應類型是_酯化反應. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②①③④ | B. | ②③④① | C. | ④②③① | D. | ④③①② |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com