
 某無色溶液中含有K+、Cl-、OH-、SO32-、SO42-,為檢驗溶液中所含的某些陰離子,限用的試劑有:鹽酸、硝酸、硝酸銀溶液、硝酸鋇溶液、溴水和酚酞溶液.檢驗其中OH-的實驗方法省略,檢驗其他陰離子的過程如圖所示.
某無色溶液中含有K+、Cl-、OH-、SO32-、SO42-,為檢驗溶液中所含的某些陰離子,限用的試劑有:鹽酸、硝酸、硝酸銀溶液、硝酸鋇溶液、溴水和酚酞溶液.檢驗其中OH-的實驗方法省略,檢驗其他陰離子的過程如圖所示.分析 (1)SO32-、SO42-與Ba(NO3)2溶液反應分別生成亞硫酸鋇和硫酸鋇白色沉淀,亞硫酸鋇與鹽酸反應生成二氧化硫氣體,二氧化硫氣體E能使溴水褪色,硫酸鋇不溶解于硝酸中,故試劑①為Ba(NO3)2溶液,試劑②為鹽酸或硝酸,試劑④為溴水,無色溶液C呈堿性,加入過量試劑③硝酸調整溶液呈酸性,再加入試劑⑤硝酸銀溶液,生成氯化銀白色沉淀;
(2)SO32-、SO42-與Ba(NO3)2溶液反應分別生成亞硫酸鋇和硫酸鋇白色沉淀,亞硫酸鋇與鹽酸反應生成二氧化硫氣體,二氧化硫能使溴水褪色,反應方程式:SO2+Br2+2H2O=H2SO4+2HBr,硫酸鋇不溶解,故試劑①為Ba(NO3)2溶液,由此可推測試劑②為某酸,與亞硫酸鋇反應放SO2氣體,但是后面需要檢測SO42-,如果加入硝酸會將SO32-氧化,影響對SO42-的判斷,故應為鹽酸,試劑④為溴水,所以現象a檢驗出的陰離子為SO32-,現象b檢驗出的陰離子為SO42-;無色溶液C呈堿性,加入過量試劑③硝酸調整溶液呈酸性,再加入試劑⑤硝酸銀溶液,生成氯化銀白色沉淀,故現象c檢驗出的陰離子為Cl-;
(3)亞硫酸鋇可以和強酸反應生成可溶性的鋇鹽和水以及二氧化硫;
(4)無色溶液A中含有OH-,OH-和硝酸銀反應生成氧化銀黑色沉淀,干擾對Cl-的檢驗,所以加入過量稀硝酸,中和OH-,防止對Cl-的檢驗產生干擾.
解答 解:(1)SO32-、SO42-與Ba(NO3)2溶液反應分別生成亞硫酸鋇和硫酸鋇白色沉淀,亞硫酸鋇與鹽酸反應生成二氧化硫氣體,二氧化硫氣體E能使溴水褪色,硫酸鋇不溶解于硝酸中,故試劑①為Ba(NO3)2溶液,試劑②為鹽酸或硝酸,試劑④為溴水,無色溶液C呈堿性,加入過量試劑③硝酸調整溶液呈酸性,再加入試劑⑤硝酸銀溶液,生成氯化銀白色沉淀,
故答案為:Ba(NO3)2;HCl;HNO3;Br2;AgNO3;
(2)SO32-、SO42-與Ba(NO3)2溶液反應分別生成亞硫酸鋇和硫酸鋇白色沉淀,亞硫酸鋇與鹽酸反應生成二氧化硫氣體,二氧化硫能使溴水褪色,反應方程式:SO2+Br2+2H2O=H2SO4+2HBr,硫酸鋇不溶解,故試劑①為Ba(NO3)2溶液,由此可推測試劑②為某酸,與亞硫酸鋇反應放SO2氣體,但是后面需要檢測SO42-,如果加入硝酸會將SO32-氧化,影響對SO42-的判斷,故應為鹽酸,試劑④為溴水,所以現象a檢驗出的陰離子為SO32-,現象b檢驗出的陰離子為SO42-;無色溶液C呈堿性,加入過量試劑③硝酸調整溶液呈酸性,再加入試劑⑤硝酸銀溶液,生成氯化銀白色沉淀,故現象c檢驗出的陰離子為Cl-,
故答案為:SO32-;SO42-;Cl-;
(3)亞硫酸鋇可以和強酸反應生成可溶性的鋇鹽和水以及二氧化硫,即BaSO3+2H+═Ba2++SO2↑+H2O,故答案為:BaSO3+2H+=Ba2++SO2↑+H2O;
(4)無色溶液A中含有OH-,OH-和硝酸銀反應生成氧化銀黑色沉淀,干擾對Cl-的檢驗,所以加入過量稀硝酸,中和OH-,防止對Cl-的檢驗產生干擾,
故答案為:中和OH-,防止對Cl-的檢驗產生干擾.
點評 本題考查無機框圖題,為高頻考點,涉及常見離子的檢驗,試題涉及物質的推斷、離子的性質及檢驗方法、化學方程式的書寫等知識,根據反應現象推斷各物質的成分是解題的關鍵,綜合性較強,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
| 起始物質的量濃度(mol/L) | 1.5 | 1 | 0 |
| 2s末物質的量濃度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
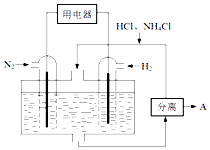 氮及其化合物在工農業生產生活中應用廣泛,請解決下列問題.
氮及其化合物在工農業生產生活中應用廣泛,請解決下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子組成相差一個或幾個CH2原子團的有機物是同系物 | |
| B. | 各組成元素質量分數相同的烴是同一種烴 | |
| C. | 分子式相同而結構式不同的有機物一定是同分異構體 | |
| D. | 具有相同通式且相差一個或若干個CH2原子團的有機物一定是同系物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{ω}{5}$ g•mol-1 | B. | 2ωg | C. | 2ω g•mol-1 | D. | 4ω g•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烷光照下能與濃鹽酸發生取代反應 | |
| B. | 乙烯可以用作生產食品包裝材料的原料 | |
| C. | 乙醇室溫下在水中的溶解度大于溴乙烷 | |
| D. | 乙酸和甲酸甲酯互為同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
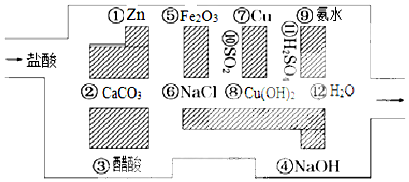
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com