
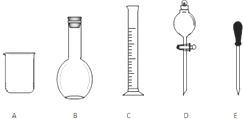
 實驗室需要0.1mol/L NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.
實驗室需要0.1mol/L NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.分析 (1)根據各儀器的作用選取儀器;
(2)根據容量瓶的構造及正確使用方法進行解答;
(3)根據m=cVM計算氫氧化鈉的質量,因實驗室無480mL規格的容量瓶,注意溶液的體積為500mL而不是480mL;
(4)依據c=$\frac{1000ρω}{M}$計算濃硫酸的物質的量濃度,依據溶液稀釋前后溶質的物質的量不變計算需要濃硫酸的體積;
(5)根據c=$\frac{n}{V}$分析操作對溶質的物質的量或對溶液的體積的影響判斷.
解答 解:(1)配制一定濃度的溶液過程中,一定不會用到燒瓶和分液漏斗,需要用500mL容量瓶配制溶液,用膠頭滴管定容,攪拌或引流用的是玻璃棒,還缺少500mL容量瓶和玻璃棒,
故答案為:BD;500mL容量瓶、玻璃棒;
(2)A.容量瓶有瓶塞,配制過程中需要搖勻,為了避免漏液,使用容量瓶前檢驗是否漏水,故A正確;
B.容量瓶為定量儀器,只能用于配制一定濃度的溶液,不能用于溶解或者稀釋溶質,故B錯誤;
C.容量瓶不能潤洗,否則會導致配制的溶液中溶質的物質的量偏大,配制的溶液濃度偏高,故C錯誤;
D.定容結束后,需要進行搖勻,操作方法為:蓋好瓶塞,用食指頂住瓶塞,另一只手托住瓶底,把容量瓶反復倒轉多次,故D正確;
故答案為:BC;
(3)0.1mol/LNaOH溶液480mL,需要配制500mL 0.1mol/L的溶液,需要氫氧化鈉的質量為:m=cVM=0.1mol/L×0.5L×40g/mol=2.0g,
故答案為:2.0;
(4)質量分數為98%、密度為1.84g/cm3的濃硫酸的物質的量濃度C=$\frac{1000×1.84g/ml×98%}{98g/mol}$=18.4mol/L,濃硫酸稀釋前后溶質的物質的量不變,設濃硫酸的體積為V,所以18.4mol/L×V=0.5/L×0.5L,V=0.0136L=13.6mL,
故答案為:13.6;
(5)①用量筒量取濃硫酸時俯視刻度線,量取的濃硫酸體積偏小,濃度偏低,故①不選;
②容量瓶用蒸餾洗滌后未干燥,因配制過程中需要滴加蒸餾水定容,故此無影響,故②不選;
③濃硫酸溶解后未冷卻即轉移、定容,未冷卻體積偏大,定容后冷卻體積偏小,濃度偏大,故③選;
④定容時仰視刻度線,導致所配溶液的液體體積偏大,濃度偏低,故④不選;
故選③.
點評 本題考查了配制一定物質的量濃度的溶液的方法,題目難度不大,明確配制步驟為解答關鍵,注意掌握配制過程中誤差分析的方法與技巧,試題有利于培養學生的化學實驗能力.


科目:高中化學 來源: 題型:選擇題
| 物質 | 熔點(℃) | 沸點(℃) | 密度(g•cm-3) | 溶解性 |
| 甲 | -68 | 115 | 0.93 | 易溶于水 |
| 乙 | -84 | 77 | 0.90 | 易溶于甲 |
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4種 | B. | 6種 | C. | 8種 | D. | 10種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | Cu | Zn | S |
| 1 | 10.3% | 5.0% | 1.2% |
| 2 | 11.5% | 4.9% | 1.8% |
| 3 | 12.4% | 10.3% | 0.9% |
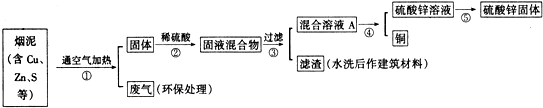
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:
如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/LCH3COOH溶液,加水稀釋過程中,所有離子濃度均減小 | |
| B. | 濃度均為0.1mol/L的NaF、CH3COONa溶液相比較,CH3COONa溶液pH大 | |
| C. | 反應HF+CH3COONa═NaF+CH3COOH可以發生 | |
| D. | NaF溶液中加少量NaOH固體,溶液中c(F-)變大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
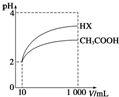 25℃時,部分物質的電離平衡常數如表所示:
25℃時,部分物質的電離平衡常數如表所示:| 化學式 | CH3COOH | H2CO3 | HClO |
| 電離平衡常數 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com