
 如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:
如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:分析 (1)根據c=$\frac{1000ρω}{M}$計算該濃鹽酸中HCl的物質的量濃度;
(2)①結合稀釋定律:c1v1=c2V2計算即可;
②依據C=$\frac{n}{V}$分析,凡是使n偏小或者V偏大的操作,都會使溶液的濃度偏小,反之,濃度偏大;
③根據配制一定物質的量濃度的溶液的步驟選擇使用的儀器.
解答 解:(1)質量分數36.5%,密度為1.19g/mL的鹽酸的物質的量濃度C=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,
故答案為:11.9;
(2)①由稀釋定律:c1v1=c2V2可知,配制500mL0.4mol/L的稀鹽酸,需用該濃鹽酸為C=$\frac{0.5×0.4}{11.9}$L=0.0168L=16.8mL,
故答案為:16.8;
②A.用量筒量取濃鹽酸進俯視觀察凹液面,量取的濃鹽酸體積偏小,濃度偏小,故A選;
B.定容后經振蕩、搖勻、靜置,發現液面下降,再加適量的蒸餾水,溶液的體積偏大,濃度偏小,故B選;
C.若容量瓶中洗凈后未干燥,殘留少量水,配制過程中需要滴加蒸餾水定容,故此無影響,故③不選;
D.定容時,眼睛俯視溶液體積偏小,濃度偏大,故D不選;
E.液體存在熱脹冷縮,未冷卻到室溫就注入容量瓶定容,溶液體積偏小,濃度偏大,故E不選;
故答案為:AB;
③配制500ml 物質的量濃度為0.400mol•L-1的稀鹽酸,應該選用500ml容量瓶;配制一定物質的量濃度的溶液步驟為:計算→稱量→溶解、冷卻→移液→洗滌→定容→搖勻→裝瓶→貼簽,一般用量筒量取濃鹽酸,在燒杯中溶解,冷卻后轉移到500mL容量瓶中,并用玻璃棒引流,轉移完畢,用少量蒸餾水洗滌燒杯及玻璃棒2~3次并將洗滌液全部轉移到容量瓶中,再加適量蒸餾水,當加水至液面距離刻度線1~2cm時,改用膠頭滴管滴加,使溶液的凹液面的最低點與刻線相平,塞好瓶塞,反復上下顛倒搖勻;所以需要的儀器為:量筒、燒杯、玻璃棒、500mL容量瓶、膠頭滴管,還缺少膠頭滴管、500mL容量瓶,
故答案為:膠頭滴管、500mL容量瓶.
點評 本題考查了一定物質的量濃度溶液的配制過程中的計算和誤差分析,屬于基礎型題目,題目難度不大,試題培養了學生的分析能力及化學檢驗能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 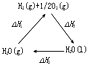 圖中△H1=△H2+△H3 | |
| B. | 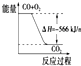 從圖可看出CO2的能量高于CO+O2 | |
| C. |  從圖可看出反應中加入催化劑可降低反應物能量 | |
| D. | 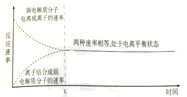 圖中t0時間段后(不包含t0)電解質溶液中,弱電解質分子與離子都存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
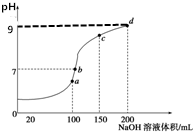 室溫時,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值與NaOH溶液體積的關系曲線如圖所示(忽略溶液混合時的體積變化),下列判斷不正確的是( )
室溫時,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值與NaOH溶液體積的關系曲線如圖所示(忽略溶液混合時的體積變化),下列判斷不正確的是( )| A. | a點所示的溶液中:c(Na+)=c(SO42-)>c(NH4+) | |
| B. | b點所示的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| C. | c點所示的溶液中:c(Na+)+c(NH4+)=2c(SO42-) | |
| D. | d點所示的溶液中:c(NH4+)+10-9mol•L-1=$\frac{{K}_{w}}{1{0}^{-9}}$mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根據這兩種溶液的配制情況回答下列問題:
實驗室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根據這兩種溶液的配制情況回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室需要0.1mol/L NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.
實驗室需要0.1mol/L NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鋁是一種重要的金屬,在生產、生活中具有許多重要的用途,如圖是從鋁土礦中制各鋁的工藝流程:
鋁是一種重要的金屬,在生產、生活中具有許多重要的用途,如圖是從鋁土礦中制各鋁的工藝流程:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸 | HCOOH | HCN | H2CO3 |
| 電離平衡常數 ( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 向NaCN溶液中通入少量的CO2發生的離子反應為:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 處理含CN-廢水時,如用NaOH溶液調節pH至9,此時c(CN-)<c(HCN) | |
| C. | 中和等體積、等pH的HCOOH溶液和HCN溶液消耗NaOH的物質的量前者小于后者 | |
| D. | 等體積、等物質的量濃度的HCOONa和NaCN溶液中所含離子總數前者大于后者 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com