
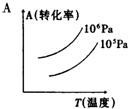
 有一化學平衡mA(g)+nB(g)═PC(g)+qD(g),如圖表示的轉化率與壓強、溫度的關系.由此得出的正確結論是( )
有一化學平衡mA(g)+nB(g)═PC(g)+qD(g),如圖表示的轉化率與壓強、溫度的關系.由此得出的正確結論是( )| A. | 正反應是吸熱反應,(m+n)>(p+q) | B. | 正反應是吸熱反應,(m+n)<(p+q) | ||
| C. | 正反應是放熱反應,(m+n)>(p+q) | D. | 正反應是放熱反應,(m+n)<(p+q) |
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
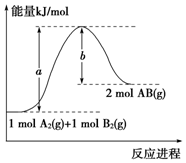
| A. | 每生成2分子AB吸收b kJ熱量 | |
| B. | 該反應過程的活化能為b kJ•mol-1 | |
| C. | 斷裂1 mol A-A和1 mol B-B鍵,放出a kJ能量 | |
| D. | 該反應的反應熱△H=+(a-b) kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 容器編號 | 溫度/℃ | 起始物質的量/mol | 平衡物質的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反應速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 該反應正反應為吸熱反應 | |
| C. | 容器Ⅱ中起始時Cl2的物質的量為0.55 mol | |
| D. | 若起始時向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,達到平衡時CO轉化率小于80% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 ;BA4的結構式
;BA4的結構式 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
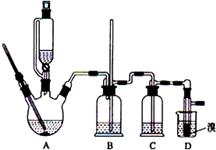 實驗室制備1,2-二溴乙烷的反應原理如下:
實驗室制備1,2-二溴乙烷的反應原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 液溴 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 | 紅色發煙液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.12 |
| 沸點/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔點/℃ | -l30 | 9 | -1l6 | -7.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 時間/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 0~20 s內,v(NO2)=0.005 mol•L-1•s-1 | |
| B. | 59 s時,c(NO2)一定大于0.12 mol•L-1 | |
| C. | 若僅將起始時充入NO2的量增至0.80 mol,則該反應的平衡常數K>$\frac{25}{9}$ | |
| D. | 若上述反應在120℃時進行,則反應至80 s時,n(N2O4)<0.08 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反應在前5 s的平均速率v(A)=0.03 mol•L-1•s-1 | |
| B. | 達到平衡時,B的轉化率為80% | |
| C. | 相同溫度下,若起始時向容器中充入2.0 mol C,則達到平衡時C的濃度小于0.2 mol•L-1 | |
| D. | 相同溫度下,起始時向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反應達到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 28 g氮氣含有的原子數為NA | |
| B. | 4g金屬鈣的物質的量為1mol | |
| C. | 1 mol O2分子的質量等于1 mol氧原子的質量 | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子數目相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com