
分析 由步驟可知,碳酸鈉水解顯堿性,可促進油污的水解,加稀硫酸除去碳酸鈉,且溶解Fe,過濾后,濾液中含Fe2+,與碳酸氫銨反應生成碳酸亞鐵沉淀,經過過濾,洗滌,干燥,灼燒得到氧化鐵;
(1)根據反應已經充分時反應停止即無現象發生判斷;
(2)①Fe3C在足量的空氣中高溫煅燒,生成有磁性的固體X,X為Fe3O4,所以該反應方程式為:Fe3C+3O2$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+CO2,據此計算;
②X為Fe3O4,將X溶于稀硫酸反應生成硫酸亞鐵、硫酸鐵,據此書寫離子方程式;
(3)步驟2濾液中含Fe2+,與碳酸氫銨反應生成碳酸亞鐵沉淀,據此書寫離子方程式;
(4)將步驟4經過過濾,洗滌,干燥,得到FeCO3固體;
(5)①根據以上分析煅燒后肯定生成氧化鐵,要檢驗產品中是否存在FeO,則應先用酸將其溶解,再用酸性KMnO4溶液檢驗含有三價鐵離子時是否含有二價鐵離子;
②假設Fe2O3物質的量為x mol,FeO的物質的量為y mol,根據質量守恒和鐵原子守恒列方程組計算.
解答 解:(1)因為反應已經充分時反應停止即無現象發生,所以當溶液中不再產生氣泡時可以判斷反應已經充分,
故答案為:溶液中不再產生氣泡;
(2)①Fe3C在足量的空氣中高溫煅燒,生成有磁性的固體X,X為Fe3O4,所以該反應方程式為:Fe3C+3O2$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+CO2,則煅燒時1mol W(Fe3C),消耗O2 3mol,
故答案為:3;
②X為Fe3O4,將X溶于稀硫酸反應生成硫酸亞鐵、硫酸鐵,則離子方程式為 Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案為:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)步驟2濾液中含Fe2+,與碳酸氫銨反應生成碳酸亞鐵沉淀,則生成FeCO3沉淀的化學方程式為FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O,故答案為:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O;
(4)將步驟4經過過濾,洗滌,干燥,得到FeCO3固體,故答案為:過濾;洗滌;
(5)①根據以上分析煅燒后肯定生成氧化鐵,要檢驗產品中是否存在FeO,則應先用酸將其溶解,再用酸性KMnO4溶液檢驗含有三價鐵離子時是否含有二價鐵離子,又酸性KMnO4溶液會氧化氯離子,所以應選用硫酸溶解,所以這兩種試劑是稀硫酸和酸性KMnO4溶液,
故答案為:稀硫酸和酸性KMnO4溶液;
②假設Fe2O3物質的量為x mol,FeO的物質的量為y mol,那么滿足:160x+72y=79200;鐵原子守恒(2x+y)×116=116000,解得x=450mol,所以產物中Fe2O3的質量160g/mol×450mol=72000g=72kg,則該產品的純度為$\frac{72g}{79.2g}$×100%=90.9%;故答案為:90.9%.
點評 本題考查元素化合物性質、基本操作與方案設計、常用化學用語等,關鍵是熟練綜合應用相關元素化合物知識,要求學生要有扎實的實驗基礎知識和靈活應用信息解決問題的能力,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:實驗題
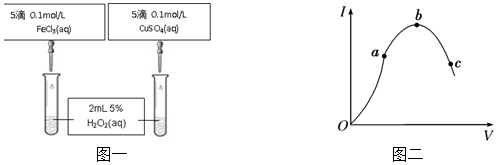
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
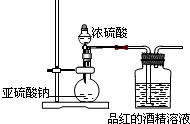
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
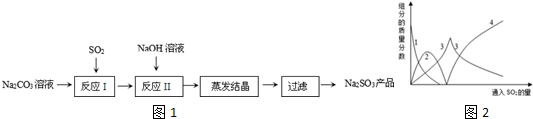
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
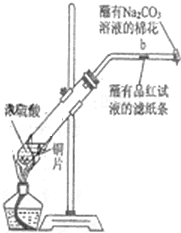 如圖所示,將6.4g銅與12mL18mol•L-1濃硫酸在試管a中共熱.據此回答:
如圖所示,將6.4g銅與12mL18mol•L-1濃硫酸在試管a中共熱.據此回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
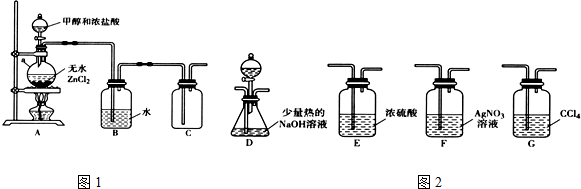
| 化學鍵 | C-Cl | C-Br |
| 鍵能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
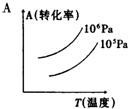 有一化學平衡mA(g)+nB(g)═PC(g)+qD(g),如圖表示的轉化率與壓強、溫度的關系.由此得出的正確結論是( )
有一化學平衡mA(g)+nB(g)═PC(g)+qD(g),如圖表示的轉化率與壓強、溫度的關系.由此得出的正確結論是( )| A. | 正反應是吸熱反應,(m+n)>(p+q) | B. | 正反應是吸熱反應,(m+n)<(p+q) | ||
| C. | 正反應是放熱反應,(m+n)>(p+q) | D. | 正反應是放熱反應,(m+n)<(p+q) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小蘇打治療胃酸過多:HCO3-+H+═CO2↑+H2O | |
| C. | 鋅片插入硝酸銀溶液中:Zn+Ag+═Zn2++Ag | |
| D. | 硫酸溶液與氫氧化銅反應:H++OH-═H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com