
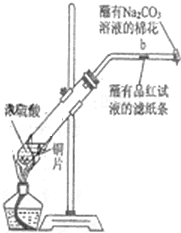
 如圖所示,將6.4g銅與12mL18mol•L-1濃硫酸在試管a中共熱.據此回答:
如圖所示,將6.4g銅與12mL18mol•L-1濃硫酸在試管a中共熱.據此回答:分析 ①銅和濃硫酸加熱反應生成硫酸銅、二氧化硫和水;
②二氧化硫能使品紅褪色;
③二氧化硫具有酸性,能和顯堿性的碳酸鈉之間反應;
④檢驗酸剩余只要檢驗溶液中存在氫離子即可.
解答 解:①銅和濃硫酸加熱反應生成硫酸銅、二氧化硫和水,反應的化學方程式為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②二氧化硫能使品紅褪色,在b處看到的實驗現象是品紅溶液褪色,故答案為:品紅溶液褪色;
③二氧化硫有毒,具有酸性,能和顯堿性的碳酸鈉之間反應,蘸有Na2CO3溶液的棉花的作用是吸收二氧化硫,故答案為:吸收二氧化硫;
④能用來證明反應結束后的燒瓶中確有余酸,實質證明氫離子的存在,
A.鐵粉與稀硫酸反應放氣體,可以證明;
B.BaCl2溶液加入后出現白色沉淀,但因為生成產物中有硫酸銅生成,也可以生成白色沉淀,故不能證明;
C.氯化亞鐵不與稀硫酸反應,不能證明;
D.Na2CO3溶液會與稀硫酸反應發出二氧化碳氣體,可以證明,
故答案為:AD.
點評 本題考查性質實驗方案的設計,題目難度中等,明確實驗目的及實驗原理為解答關鍵,注意隨反應進行濃硫酸變為稀硫酸后不與銅發生反應,試題側重考查學生的分析能力及化學實驗能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 容器編號 | 溫度/℃ | 起始物質的量/mol | 平衡物質的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反應速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 該反應正反應為吸熱反應 | |
| C. | 容器Ⅱ中起始時Cl2的物質的量為0.55 mol | |
| D. | 若起始時向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,達到平衡時CO轉化率小于80% |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
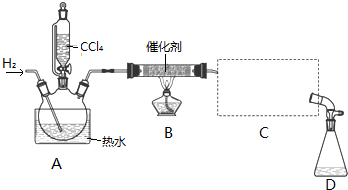
| 物質 | 相對分子質量 | 密度/(g•mL-1) | 沸點/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 難溶 |
| CCl4 | 154 | 1.59 | 76.7 | 難溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 ;BA4的結構式
;BA4的結構式 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 時間/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 0~20 s內,v(NO2)=0.005 mol•L-1•s-1 | |
| B. | 59 s時,c(NO2)一定大于0.12 mol•L-1 | |
| C. | 若僅將起始時充入NO2的量增至0.80 mol,則該反應的平衡常數K>$\frac{25}{9}$ | |
| D. | 若上述反應在120℃時進行,則反應至80 s時,n(N2O4)<0.08 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 不慎將酸濺到眼中,應立即用水沖洗,邊洗邊眨眼睛 | |
| B. | 不慎將濃堿沾到皮膚上,應立即用大量水沖洗,然后涂上硼酸溶液 | |
| C. | 稀釋濃硫酸時,將濃硫酸沿器壁慢慢注入水中,并不斷攪拌 | |
| D. | 實驗室中酒精燃燒,小面積著火,立即用水撲滅 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com