
| 時間/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 0~20 s內,v(NO2)=0.005 mol•L-1•s-1 | |
| B. | 59 s時,c(NO2)一定大于0.12 mol•L-1 | |
| C. | 若僅將起始時充入NO2的量增至0.80 mol,則該反應的平衡常數K>$\frac{25}{9}$ | |
| D. | 若上述反應在120℃時進行,則反應至80 s時,n(N2O4)<0.08 mol |
分析 A、速率之比等于對應物質的化學計量數之比;
B、隨反應的進行反應物的濃度減少,但59 s時是否是平衡狀態不知;
C、平衡常數是溫度的函數;
D、2NO2(g)?N2O4(g)△H<0,正反應是放熱反應,升高溫度平衡向逆反應方向移動;
解答 解:A、0~20 s內,v(N2O4)=$\frac{\frac{0.05}{2}}{20}$=0.00125 mol•L-1•s-1,根據速率之比等于對應物質的化學計量數之比,所以v(NO2)=0.0025 mol•L-1•s-1,故A錯誤;
B、60 s時△n(N2O4)=0.08mol,所以60s時△n(NO2)=0.16mol,所以如果59 s未平衡,n(NO2)>0.40-0.16=0.24mol,則c(NO2)一定大于0.12 mol•L-1,如果平衡c(NO2)等于0.12 mol•L-1,故B錯誤;
C、60s反應達平衡狀態,平衡常數為:K=$\frac{\frac{0.08}{2}}{(\frac{0.4-0.16}{2})^{2}}$=$\frac{25}{9}$,所以若僅將起始時充入NO2的量增至0.80 mol,則該反應的平衡常數K=$\frac{25}{9}$,故C錯誤;
D、2NO2(g)?N2O4(g)△H<0,正反應是放熱反應,升高溫度平衡向逆反應方向移動,所以反應在120℃時進行,則反應至80 s時,n(N2O4)<0.08 mol,故D正確;
故選D.
點評 本題考查化學反應速率計算、化學平衡影響因素、平衡的移動等,難度不大,C選項平衡常數的計算,學生還應清楚平衡常數是溫度的函數.


 浙大優學小學年級銜接捷徑浙江大學出版社系列答案
浙大優學小學年級銜接捷徑浙江大學出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 增大壓強,平衡向右移動 | B. | 加入催化劑,Z的產率增大 | ||
| C. | 增大c(X),X的轉化率增大 | D. | 降低溫度,Y的轉化率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
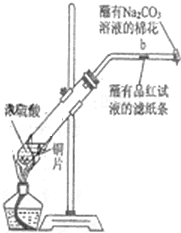 如圖所示,將6.4g銅與12mL18mol•L-1濃硫酸在試管a中共熱.據此回答:
如圖所示,將6.4g銅與12mL18mol•L-1濃硫酸在試管a中共熱.據此回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
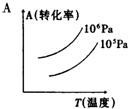 有一化學平衡mA(g)+nB(g)═PC(g)+qD(g),如圖表示的轉化率與壓強、溫度的關系.由此得出的正確結論是( )
有一化學平衡mA(g)+nB(g)═PC(g)+qD(g),如圖表示的轉化率與壓強、溫度的關系.由此得出的正確結論是( )| A. | 正反應是吸熱反應,(m+n)>(p+q) | B. | 正反應是吸熱反應,(m+n)<(p+q) | ||
| C. | 正反應是放熱反應,(m+n)>(p+q) | D. | 正反應是放熱反應,(m+n)<(p+q) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
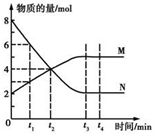
| A. | 反應的化學方程式為2 M?N | |
| B. | t2 min時,正逆反應速率相等,反應達到平衡 | |
| C. | t3 min后,正逆反應仍在進行 | |
| D. | t3~t4 min時,v正(N)=v逆(M) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 次氯酸是一種弱酸是因為次氯酸不穩定,易分解 | |
| B. | 用氯氣制漂白粉的主要目的是轉變為較穩定,便于貯存的物質 | |
| C. | 漂白粉在空氣中容易失效的原因是次氯酸鈣易和空氣中的水及二氧化碳反應 | |
| D. | 氯原子最外層有7個電子,故在化學反應中易結合一個電子而形成Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com