

分析 (1)①利用三段式法計算平衡濃度,根據平衡常數表達式計算;
②平衡常數只受溫度的影響,溫度不變,平衡常數不變;③根據S元素守恒n(CaSO4•2H2O)=n(SO2),再根據m=nM計算石膏的質量;
(2)利用蓋斯定律計算反應熱;
(3)從氧化還原反應的角度判斷反應產物,進而寫出相關反應的方程式;
①依據氧化還原反應的電子守恒計算ZnFe2Oy中Fe元素化合價,再根據化合物中的元素化合價代數為0計算y的值;
②依據氧化還原反應的電子守恒計算ZnFe2Oz中Fe元素化合價,根據化合價確定+2Fe與+3價Fe的原子數目之比,據此書寫氧化物氧化物形式的化學式;再根據化合物中的元素化合價代數為0計算z的值,據此改寫.
解答 解:(1)①由圖象知,體系總壓強為0.10MPa時SO2的平衡轉化率為0.8,則
2SO2(g)+O2(g) $?_{△}^{催化劑}$ 2SO3(g)
起始:2.0mol 1.0mol 0
轉化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
則平衡時:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,
K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$=$\frac{0.1{6}^{2}}{0.0{4}^{2}×0.02}$=800,
故答案為:800;
②平衡常數只受溫度的影響,溫度不變,則壓強不變,平衡狀態由A變到B時,則k(A)=k(B),
故答案為:=;
③根據S元素守恒n(CaSO4•2H2O)=n(SO2)=1.5mol,故石膏的質量為1.5mol×172g/mol=258g,
故答案為:258;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
利用蓋斯定律將$\frac{①+②}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ/mol
n(CH4)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
整個過程中轉移的電子總數為:0.20mol×8NA=1.60NA,
放出的熱量為:0.2mol×867kJ/mol=173.4kJ,
故答案為:1.60NA(或1.6NA);173.4;
(3)由題意可知,鐵酸鹽(MFe2O4)經高溫還原而得,則反應物中MFe2Ox為還原劑,SO2為氧化劑,生成物為MFe2O4和S,則反應的關系式為MFe2Ox+SO2→MFe2O4+S,
故答案為:MFe2Ox+SO2→MFe2O4+S;
①2mol ZnFe2Oy與足量NO2可生成0.5mol N2,則ZnFe2Oy被還原為ZnFe2O4,令ZnFe2Oy中鐵元素的化合價為a,根據電子轉移守恒,可知2mol×2×(3-a)=0.5mol×2×4,解得a=2,化合價代數和為0,則2+2×2=2y,解得y=3,故答案為:3;
②1molZnFe2Oz最多能使4.0L(標況)NO1.4轉化為N2,則ZnFe2Oz被還原為ZnFe2O4,令ZnFe2Oz中鐵元素的化合價為b,根據電子轉移守恒,可知1mol×2×(3-b)=$\frac{4L}{22.4L/mol}$×2.8,解得b=2.75,令+2Fe與+3價Fe的原子數目之比為m:n,根據平均化合價,則2m+3n=2.75m+2.75n,整理得m:n=1:3,氧化物化學式為aZnO•2FeO•3Fe2O3,化學式中n(Fe)=2n(Zn),故a=4,即氧缺位鐵酸鋅ZnFe2Oz的氧化物形式為4ZnO•2FeO•3Fe2O3,故答案為:4ZnO•2FeO•3Fe2O3.
點評 本題以消除NOx污染治理為載體,考查化學平衡常數、氧化還原反應計算、根據方程式的計算等,題目計算量較大,數據繁瑣,是對學生心理素質的考驗,難度較大,為易錯題.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 如果某化合物只含共價鍵,則其一定是共價化合物 | |
| B. | 焓變小于0而熵變大于0的反應肯定是自發反應 | |
| C. | 對于給定條件下反應物之間同時發生多個反應的情況,理想的催化劑可以大幅度提高目標產物在最終產物中的比率 | |
| D. | 綠色化學的核心是利用化學原理對產生的環境污染進行治理 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
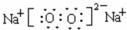 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸化學式 | HX | HY | H2CO3 |
| 電離平衡常數 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | HX、HY兩種弱酸的酸性:HX<HY | |
| B. | 相同條件下溶液的堿性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 結合H+的能力:CO32->Y->X->HCO3- | |
| D. | HX與Na2CO3反應,無氣泡產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
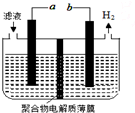 某研究小組利用電化學方法處理石油煉制過程中產生的含H2S的廢氣.基本工藝是將H2S通入FeCl3溶液中,過濾后將濾液加入電解槽中電解,如圖所示,下列有關說法正確的是( )
某研究小組利用電化學方法處理石油煉制過程中產生的含H2S的廢氣.基本工藝是將H2S通入FeCl3溶液中,過濾后將濾液加入電解槽中電解,如圖所示,下列有關說法正確的是( )| A. | 過濾得到的沉淀可能是FeS | |
| B. | 與a極相連的電極反應式為2Cl--2e-=Cl2 | |
| C. | 可以用Fe與外接電源的a極相連 | |
| D. | 電解后的濾液可以循環利用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該烴X與等質量的甲烷相比,X燃燒時消耗的氧氣更多 | |
| B. | 分子中碳原子的化學環境有2種 | |
| C. | 分子中的氫原子分布在兩個互相垂直的直線上 | |
| D. | 分子中既有C-C鍵也有C=C鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳、氫、氧的原子個數比為1:2:3 | |
| B. | 碳、氫的原子個數比為1:1 | |
| C. | 該有機物中肯定不含氧元素 | |
| D. | 不能判斷該有機物中是否含有氧元素 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com