
 .
.分析 (1)Ca是20號元素,鈣原子核外電子數為20,有3個電子層,各層電子數為2、8、8、1,對于主族元素,電子層數=周期數,最外層電子數=族序數;
(2)最活潑的非金屬元素A為F,則Ca與最活潑的非金屬元素F形成化合物D為CaF2,A與Mg形成的化合物E為MgF2,都為離子晶體,根據離子晶體判斷沸點高低;
(3)根據得失電子數相等配平方程式;
(4)鈣線試樣溶于稀鹽酸后,加入過量NaOH溶液,生成白色絮狀沉淀并迅速變成灰綠色,最后變成紅褐色M(OH)n,M為Fe元素,利用Fe3+與SCN-結合生成紅色物質檢驗鐵離子;
(5)鈣與水反應生成氫氧化鈣與氫氣,根據n=$\frac{V}{V{\;}_{m}}$計算氫氣的物質的量,根據電子轉移守恒計算Ca的物質的量,根據氧化鈣的質量分數計算氧化鈣的質量,計算氧化鈣的物質的量,氧化鈣與水反應生成氫氧化鈣,氫氧化鈣與二氧化碳反應生成碳酸鈣,根據鈣元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO),再根據m=nM計算碳酸鈣的質量.
解答 解:(1)Ca是20號元素,鈣原子核外電子數為20,有3個電子層,各層電子數為2、8、8、1,處于周期表中第四周期第ⅡA族,其原子結構示意圖為 ,
,
故答案為:第四周期第ⅡA族; .
.
(2)最活潑的非金屬元素A為F,則Ca與最活潑的非金屬元素F形成化合物D為CaF2,A與Mg形成的化合物E為MgF2,因為鈣離子半徑比鎂離子半徑大,MgF2的晶格能比CaF2大,所以D的沸點比E低,
故答案為:低;
(3)該方程式中元素的化合價變化為:P→Ca3(PO4)2,磷元素由0價→+5價,一個磷原子失5個電子;
FeO→Fe,鐵元素由+2價→0價,一個 FeO得2個電子,根據氧化還原反應中得失電子數相等,所以其最小公倍數為10,故 P的計量數為2,FeO的計量數為5,其它元素根據原子守恒配平,所以該方程式為:2P+5FeO+3CaO$\frac{\underline{\;高溫\;}}{\;}$Ca3(PO4)2+5Fe
故答案為:2;5;3;1;5;
(4)鈣線試樣溶于稀鹽酸后,加入過量NaOH溶液,生成白色絮狀沉淀并迅速變成灰綠色,最后變成紅褐色M(OH)n,M為Fe元素,發生的化學方程式為:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe3+與SCN-結合生成紅色物質檢驗Fe3+,離子方程式為Fe3++3SCN-=Fe(SCN)3,
故答案為:Fe;FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe3++3SCN-=Fe(SCN)3;
(5)224mLH2的物質的量為$\frac{0.224L}{22.4L/mol}$=0.01mol,鈣與水反應生成氫氧化鈣與氫氣,根據電子轉移守恒可知,Ca的物質的量為$\frac{0.01mol×2}{2}$=0.01mol,樣品中CaO質量分數為3.5%,故氧化鈣的質量為1.6g×3.5%=0.056g,故氧化鈣的物質的量為$\frac{0.056g}{56g/mol}$=0.001mol,氧化鈣與水反應生成氫氧化鈣,氫氧化鈣與二氧化碳反應生成碳酸鈣,根據鈣元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.01mol+0.001mol=0.011mol,碳酸鈣的質量為0.011mol×100g/mol=1.1g,
故答案為:1.1.
點評 本題考查結構與位置關系、常用化學用語書寫、氧化還原反應、化學計算等,題目綜合性較大,難度中等,(5)中注意利用守恒進行計算.


科目:高中化學 來源: 題型:選擇題
| A. | 氯化氫分子的電子式: | B. | 硫化氫分子的S2-的結構示意圖是: | ||
| C. | O-18原子的符號:818O | D. | CO2分子的結構式:O=C=O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
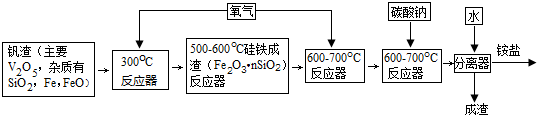
| 溫度K | 293 | 373 | 773 |
| 質量(g) | 133.6 | 106.6 | 91.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
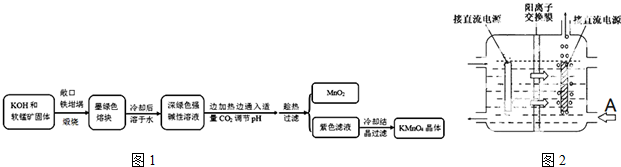
| 物質 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚乙炔是乙炔發生聚合反應形成的高聚物 | |
| B. | 聚乙炔的化學式為 | |
| C. | 聚乙炔是一種碳原子之間以單雙鍵交替結合的鏈狀結構的物質 | |
| D. | 聚乙炔不可能發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 它們互為同分異構體 | B. | 沸點較高的是甲酸乙酯 | ||
| C. | 它們可用紅外光譜法鑒別 | D. | 它們可用KMnO4(H+)溶液鑒別 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 戊酸丁酯 | B. | 葡萄糖 | C. | 丙酸丙酯 | D. | 甲酸乙酯 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com