
 (1)已知:在常溫下,濃度均為0.1mol•L-1的下列六種溶液的pH:
(1)已知:在常溫下,濃度均為0.1mol•L-1的下列六種溶液的pH:| 溶質 | CH3CO ONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
分析 (1)強堿弱酸鹽水解顯示堿性,溶液的pH越大,水解程度越大,對應的酸的酸性越弱,復分解反應中,堿性強的物質置換堿性弱的物質,酸性強的物質置換酸性弱的物質.根據以上知識對各選項進行判斷即可;
(2)濃度均為0.05mol/L的六種物質的溶液,氫離子濃度越大pH越小,反之越大,強酸的電離程度大于弱酸的電離程度;酸性越弱,稀釋相同倍數變化越小;
(3)少量氯氣通入碳酸鈉溶液中,二者反應生成碳酸氫鈉、氯化鈉和次氯酸鈉;
(4)標準狀況下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不斷通入CO2至過量,反應過程是二氧化碳和氫氧根離子反應生成碳酸根離子,碳酸根離子和鈣離子反應生成碳酸鈣沉淀,鈣離子沉淀完,二氧化碳繼續和氫氧根離子反應生成碳酸根離子,氫氧根離子全部反應后,二氧化碳和碳酸根離子反應生成碳酸氫根離子,繼續通入二氧化碳和碳酸鈣沉淀反應生成碳酸氫鈣,沉淀溶解,依據反應的定量關系畫出圖象.
解答 解:(1)A.C6H5ONa溶液的pH=11.3<Na2CO3溶液的pH=11.6,所以CH3COOH+Na2CO3═NaHCO3+CH3COONa能成立,故A不選;
B.NaCN溶液的pH=11.1>CH3COONa溶液的pH=8.8,所以CH3COOH+NaCN=CH3COONa+HCN能成立,故B不選;
C.由表可知NaClO溶液的pH=10.3<Na2CO3溶液的pH=11.6,所以CO2+H2O+2NaClO=Na2CO3+2HClO不能成立,由表可知NaClO溶液的pH=10.3>NaHCO3溶液的pH=9.7,所以CO2+H2O+NaClO=NaHCO3+HClO能成立,故C選;
D.C6H5ONa溶液的pH=11.3>NaHCO3溶液的pH=9.7,所以CO2+H2O+C6H5ONa→NaHCO3+C6H5OH能成立,由表可知、C6H5ONa溶液的pH=11.3<Na2CO3溶液的pH=11.6,所以CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH不能成立,故D選;
故答案為:CD;
(2)均為0.05mol•L-1的下列六種物質的溶液,只有硫酸是二元強酸,電離出的氫離子濃度最大,所以酸性最強,pH最小,根據表中pH數據,可知幾種物質苯酚的酸性最弱,電離程度最小,所以氫離子濃最小,pH最大,苯酚酸性最弱,則苯酚稀釋時pH變化最小,故答案為:⑤;①;
(3)少量氯氣通入碳酸鈉溶液中,二者反應生成碳酸氫鈉、氯化鈉和次氯酸鈉,離子方程式為:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-,故答案為:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-;
(4)標準狀況下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中含氫氧根離子為0.3mol,不斷通入CO2至過量,CO2+2OH-═CO32-+H2O,Ca2++CO32-═CaCO3↓,CO2+2OH-═CO32-+H2O,CO32-+CO2+H2O═2HCO3-,CaCO3+CO2+H2O═Ca(HCO3)2,生成碳酸鈣最大量為0.1mol,消耗氫氧根離子0.2mol,消耗二氧化碳氣體0.1mol,標準狀況體積為2.24L,剩余氫氧根離子為0.1mol,生成碳酸根離子物質的量為0.05mol,消耗二氧化碳0.05mol,繼續通入二氧化碳和碳酸根離子反應生成碳酸氫根離子,消耗二氧化碳0.05mol,沉淀不變消耗二氧化碳0.1mol,標準狀況體積為2.24L,再繼續通入二氧化碳溶解碳酸鈣沉淀需要二氧化碳0.1mol,標準狀況體積為2.24L,由數據繪制圖形得到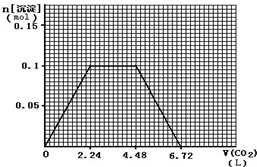 ,
,
故答案為: .
.
點評 本題考查較綜合,涉及鹽類水解的應用、溶液酸堿性及化學方程式的書寫等,把握反應原理為解答的關鍵,注重高頻考點的考查,注意利用計算判斷反應過程中物質的量的變化來繪制圖象,題目難度中等.


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 “白鐵皮”具有較強的耐腐蝕性,是生產中常用的金屬材料之一.鍍鋅層猶如鐵皮的保護層,這層膜的厚度及均勻度也成了判斷鍍層質量的重要指標.某研究性學習小組為了測定鍍鋅鐵皮的厚度,設計了下面的實驗方案:
“白鐵皮”具有較強的耐腐蝕性,是生產中常用的金屬材料之一.鍍鋅層猶如鐵皮的保護層,這層膜的厚度及均勻度也成了判斷鍍層質量的重要指標.某研究性學習小組為了測定鍍鋅鐵皮的厚度,設計了下面的實驗方案:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
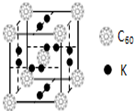 C60以其完美的球形結構受到科學家的高度重視,從此掀起了球形分子的研究熱潮.繼C60后,科學家又合成了Si60、N60等球形分子.
C60以其完美的球形結構受到科學家的高度重視,從此掀起了球形分子的研究熱潮.繼C60后,科學家又合成了Si60、N60等球形分子.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
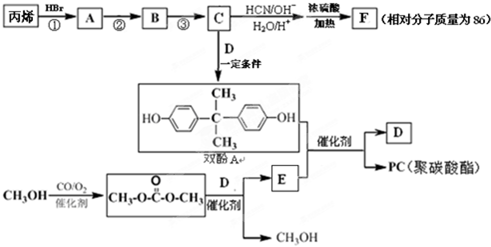

 .
.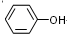 .
. .
.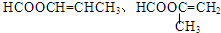 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
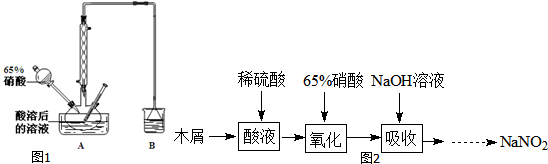
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com