
| A. | 原子半徑:X>Y>Z | B. | 原子序數:X<Y<Z | ||
| C. | 氣態氫化物穩定性:X<Y<Z | D. | 非金屬性:X>Y>Z |
分析 同周期自左而右元素非金屬性增強,非金屬性越強,最高價氧化物對應水化物的酸性越強,最高價氧化物對應水化物的酸性是:HXO4>H2YO4>H3ZO4,則非金屬性X>Y>Z,原子序數:X>Y>Z;同周期元素的原子從左到右,原子半徑逐漸減小、氫化物的穩定性逐漸增強,以此解答該題.
解答 解:同周期自左而右元素非金屬性增強,非金屬性越強,最高價氧化物對應水化物的酸性越強,最高價氧化物對應水化物的酸性是:HXO4>H2YO4>H3ZO4,則非金屬性X>Y>Z,原子序數:X>Y>Z;同周期元素的原子從左到右,原子半徑逐漸減小、氫化物的穩定性逐漸增強.
A.同周期從左到右非金屬性增強,原子半徑逐漸減小,所以原子半徑:X<Y<Z,故A錯誤;
B.非金屬性X>Y>Z,同周期從左到右元素非金屬性增強,可知原子序數的關系為X>Y>Z,故B錯誤;
C.非金屬性越強,氫化物越穩定,由于非金屬性X>Y>Z,所以氣態氫化物的穩定性:HX>H2Y>ZH3,故C錯誤;
D.最高價氧化物對應水化物的酸性是:HXO4>H2YO4>H3ZO4,則非金屬性X>Y>Z,故D正確.
故選D.
點評 本題考查元素周期律知識,為高頻考點,側重于學生的分析能力的考查,題目難度不大,注意相關性質的比較角度以及元素周期律的主要遞變規律.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在蔗糖中加入濃硫酸后出現發黑現象,說明濃硫酸具有吸水性 | |
| B. | 向某溶液中加入氯化鋇溶液和稀硝酸,生成白色沉淀,則原溶液一定含有SO42- | |
| C. | 常溫下,將銅放入濃硫酸中無明顯變化,說明銅在冷的濃硫酸中鈍化 | |
| D. | 濃硝酸在光照下變黃,證明硝酸不穩定,且產物有紅棕色氣體可溶于濃硝酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
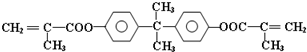
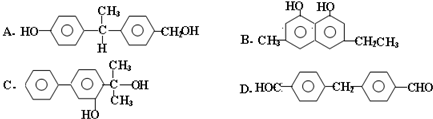
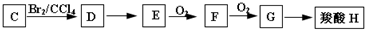
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4HCO3和鹽酸的反應是放熱反應 | |
| B. | 反應的熱化學方程式為:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 | |
| C. | 反應物的總能量高于生成物的總能量 | |
| D. | 該反應中,反應物吸收環境中的熱量轉化為產物內部的能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 難溶 | 難溶 | 易溶 |
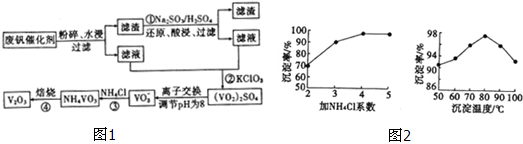
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 每一周期的元素都從堿金屬開始,最后以稀有氣體結束 | |
| B. | 第二、三周期上下相鄰的元素的原子核外電子數相差8個 | |
| C. | 只有第2列元素的原子最外層有2個電子 | |
| D. | 元素周期表共有十六個縱行,也就是十六個族 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同物質的量的烴,完全燃燒,生成的CO2越多,說明烴中的碳的質量分數越大 | |
| B. | 相同質量的烴,完全燃燒,消耗的O2越多,說明烴中的氫的質量分數越大 | |
| C. | 銀鏡反應實驗后試管內壁附有銀,可用氨水清洗 | |
| D. | 氟利昂(CF2Cl2)或氮氧化物(NOx)氣體會破壞大氣臭氧層,從而導致“溫室效應” |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應熱就是反應中放出的能量 | |
| B. | 在101 kPa時,1mol碳燃燒所放出的熱量為碳的燃燒熱 | |
| C. | 等量的硫蒸氣和硫固體分別完全燃燒,前者放出的熱量少 | |
| D. | 由C(石墨)═C(金剛石)△H=+1.9 kJ•mol-1可知,石墨穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
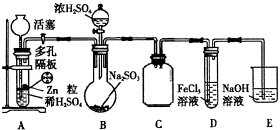
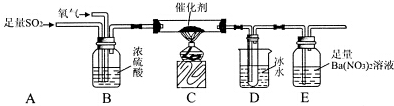
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com