
| 物質 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 難溶 | 難溶 | 易溶 |
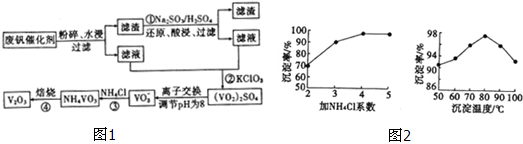
分析 反應①是利用亞硫酸鈉在酸性溶液中的還原性把難溶的V2O5轉化為易溶于水的VOSO4便于釩的提取,反應②是用氯酸鈉溶液與VOSO4反應生成(VO2)2SO4,通過離子交換,調節溶液PH得到NaVO3,反應③是NaVO3溶液與氯化銨反應生成NH4VO3沉淀,反應④加熱NH4VO3分解為V2O5,
(1)鋁熱反應實質是置換反應,鋁與五氧化二釩反應生成釩與氧化鋁;
(2)根據廢釩催化劑的組成及表中數據判斷濾液主要成分;
(3)依據流程中的沉淀分離書寫離子方程式;根據題中圖象分析坐標系中表示的含義,結合圖中的沉礬率與沉淀溫度關系選擇最佳溫度,再根據沉礬率與氯化銨系數選擇最佳的氯化銨系數;
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,發生氧化還原反應生成二氧化碳、VO2+和水,離子方程式中一定滿足質量守恒和電荷守恒,計算二氧化碳物質的量,結合離子方程式定量關系計算電子轉移;
(5)電池充電時陽極發生氧化反應,陽極電極反應為VO2++得到電子發生氧化反應生成VO2+.
解答 解:反應①是利用亞硫酸鈉在酸性溶液中的還原性把難溶的V2O5轉化為易溶于水的VOSO4便于釩的提取,反應②是用氯酸鈉溶液與VOSO4反應生成(VO2)2SO4,通過離子交換,調節溶液PH得到NaVO3,反應③是NaVO3溶液與氯化銨反應生成NH4VO3沉淀,反應④加熱NH4VO3分解為V2O5,
(1)鋁與五氧化二釩反應生成釩與氧化鋁,反應方程式為3V2O5+10Al $\frac{\underline{\;高溫\;}}{\;}$6V+5Al2O3,故答案為:3V2O5+10Al$\frac{\underline{\;高溫\;}}{\;}$6V+5Al2O3;
(2)廢釩催化劑中含有V2O5、VOSO4及不溶性殘渣,由于V2O5為難溶物,所以濾液中含釩的主要成分為VOSO4,故答案為:VOSO4 ;
(3)根據NH4VO3難溶于水,利用復分解反應沉淀VO3-,離子方程式為NH4++VO3-=NH4VO3↓,根據沉釩率與沉淀溫度的圖象可知,在80℃時沉礬率最高為98%,再根據氯化銨系數與沉釩率可知,氯化銨系數為4時沉釩率最高,所以最佳控制氯化銨系數和溫度分別為4、80℃,
故答案為:NH4++VO3-=NH4VO3↓;4;80℃;
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,發生氧化還原反應生成二氧化碳、VO2+和水,離子方程式為:2VO2++H2C2O4+2H+═2VOn++2CO2↑+2H2O,根據電二氧化碳物質的量n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,離子方程式中每生成2molCO2電子轉移為2mole-,則0.1mol二氧化碳生成電子轉移為0.1NA,
故答案為:2VO2++H2C2O4+2H+═2VOn++2CO2↑+2H2O;0.1NA;
(5)陽極反應是氧化反應,由電池總反應可知充電時,陽極電極反應為VO2++得到電子發生氧化反應生成VO2+,陽極電極反應為VO2++H2O-e-=VO2++2H+,
故答案為:VO2++H2O-e-=VO2++2H+.
點評 本題考查了鋁熱反應、氧化還原反應、離子反應、電化學等知識,題目難度中等,正確分析、理解工業流程是解題關鍵,注意明確鋁熱反應原理及電荷守恒、質量守恒在配平反應方程式中的應用.


 學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案
學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案 芒果教輔暑假天地重慶出版社系列答案
芒果教輔暑假天地重慶出版社系列答案科目:高中化學 來源: 題型:解答題
| 元 素 | M | F | |
| 電能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔點/K | 沸點/K | 標準狀況時在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 工業上,乙苯主要通過苯與乙烯在合適條件下加成反應獲得 | |
| B. | 實驗室制得的溴苯含有多種有機雜質,除了苯之外,還可能含 | |
| C. | 萘( )不是苯的同系物,應屬于聯苯類芳香烴 )不是苯的同系物,應屬于聯苯類芳香烴 | |
| D. | D.甲苯與氯氣在光照下反應生成的一氯代物主要為 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 物質 | 組成和結構信息 |
| a | 含有A的二元離子化合物 |
| b | 含有共價鍵的二元離子化合物,且原子數之比為1:1 |
| c | 化學組成為AFD |
 ;c的結構式為H-O-Cl.
;c的結構式為H-O-Cl.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:X>Y>Z | B. | 原子序數:X<Y<Z | ||
| C. | 氣態氫化物穩定性:X<Y<Z | D. | 非金屬性:X>Y>Z |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 相關實驗 | 預期目的 | |
| ① | 在兩份同濃度同體積的H2O2溶液中,分別加2滴FeCl3溶液和2滴CuCl2溶液,前者放在熱水中,后者放在冰水中.觀察氣泡快慢; | 驗證溫度對化學反應速率的影響. |
| ② | 將氯水加入淀粉KI溶液中 | 驗證Cl的非金屬性比I強 |
| ③ | 在相同溫度下,將表面積相同的鋁條和鎂條投入等體積同濃度的鹽酸中,觀察產生氣泡的速率. | 比較同周期金屬元素的金屬性強弱. |
| ④ | 利用電解質溶液的導電性裝置,檢測AlCl3溶液的導電性 | 證明AlCl3是離子化合物 |
| A. | 僅① | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素Q所形成的氧化物只有一種 | |
| B. | 元素M的最高價氧化物對應的水化物為強酸 | |
| C. | 元素C、D、N的最高價氧化物對應的水化物兩兩之間可發生反應 | |
| D. | 氫化物的穩定性:Q>M |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com