
分析 (1)原電池反應必須是自發進行的放熱的氧化還原反應,根據是否有電子轉移判斷是否能設計成原電池;
(2)原電池反應必須是自發進行的放熱的氧化還原反應;
(3)原電池反應中,化合價升高的金屬單質作負極,不如負極活潑的金屬或導電的非金屬作正極,得電子化合價降低的電解質溶液作該原電池電解質溶液;
(4)活潑的金屬作負極,碳棒作正極,電解質溶液為氯化鐵溶液,電子從負極流向正極,要形成閉合回路;
(5)由電極反應式可知Fe-2e-=Fe2+,若導線上轉移電子2mol,則電解質溶液增重為56g.
解答 解:(1)原電池反應必須是自發進行的放熱的氧化還原反應,(A)中各元素化合價不變,所以不是氧化還原反應,屬于復分解反應,不能設計成原電池;(B)中反應前后Fe元素化合價由+3價變為+2價、Cu元素化合價由0價變為+2價,所以有電子轉移,能設計成原電池,
故答案為:B;
(2)根據(1)知,(A)的反應非氧化還原反應,沒有電子轉移,所以(A)不能設計成原電池,故答案為:(A)的反應非氧化還原反應,沒有電子轉移;
(3)負極是活潑的金屬,可以用活潑的鐵作為負極材料,負極發生氧化反應,電極反應式為:Fe-2e-=Fe2+;正極是不活潑的碳棒,發生還原反應,電極反應式為:2Fe3++2e-=2Fe2+;故答案為:Fe-2e-=Fe2+,2Fe3++2e-=2Fe2+;
(4)活潑的金屬作負極,碳棒作正極,電解質溶液為氯化鐵溶液,電子從負極流向正極,要形成閉合回路,圖為: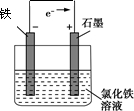 ,故答案為:
,故答案為: ;
;
(5)由電極反應式可知Fe-2e-=Fe2+,若導線上轉移電子2mol,則電解質溶液增重為56g,所以外電路中有6.02×1023個電子轉移時,即轉移1mol的電子,所以電解質溶液增重28g,故答案為:28.
點評 本題考查了原電池的設計和工作原理的探究,為側重于基礎知識的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | ①③⑦ | B. | ②⑥⑦ | C. | ①④⑧ | D. | ②⑦⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硅單質廣泛用于制作光導纖維 | |
| B. | SO2使氯水褪色,說明SO2具有漂白性 | |
| C. | 氯氣泄漏后應順風向低處跑 | |
| D. | 酸雨的pH值小于5.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相對分子質量相同而結構不同的化合物互稱為同分異構體 | |
| B. | 分子式相同而結構不同的化合物互稱為同分異構體 | |
| C. | 同分異構體之間由于分子組成相同,所以它們的性質相同 | |
| D. | 只有少數的有機物之間存在同分異構現象 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2、N2、CCl4 | B. | CH4、NH3、H2O | C. | CO2、CS2、Cl2 | D. | HCl、NO、Br2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿金屬元素隨原子序數的遞增原子半徑逐漸減小 | |
| B. | 堿金屬元素隨原子序數的遞增離子氧化性逐漸減弱 | |
| C. | 堿金屬元素的單質在氧氣點燃都生成過氧化物 | |
| D. | 堿金屬元素隨原子序數的遞增最高價氧化物對應的水化物堿性逐漸減弱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com