
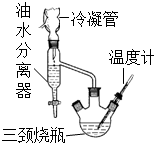
 乳酸乙酯(2-羥基丙酸乙酯)常用于調制果香型、乳香型食用和酒用香精.為了在實驗室制取乳酸乙酯,某研究性學習小組同學首先查閱資料,獲得下列信息:
乳酸乙酯(2-羥基丙酸乙酯)常用于調制果香型、乳香型食用和酒用香精.為了在實驗室制取乳酸乙酯,某研究性學習小組同學首先查閱資料,獲得下列信息:| 物質 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸點/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
分析 (1)酯化反應過程中需要濃硫酸作催化劑和吸水劑;形成水、乙醇、苯共沸物,分離反應生成的水,促進酯化反應正向進行;油水分離器中液體不再變化說明反應結束;
(2)水洗的目的主要是除去催化作用的硫酸,因此洗滌液顯酸性;
(3)乳酸乙酯分子的結構簡式為CH3CH(OH)COOCH2CH3,分子中有5種不同環境的氫原子.
解答 解:(1)酯化反應利用濃硫酸作催化劑和吸水劑,故缺少濃硫酸,酯化反應是可逆反應,混合物中添加苯可形成水、乙醇、苯共沸物,分離反應生成的水,促進酯化反應正向進行,如果收集裝置中液體的量不再增加說明反應已經完全,
故答案為:濃硫酸;形成水、乙醇、苯共沸物,分離反應生成的水,促進酯化反應正向進行;油水分離器中液體不再增加;
(2)最后一次洗滌液不顯酸性,可說明洗滌完全,因此只要測定一下最后一次水洗液的pH到7即可判斷,故答案為:測定水洗液的pH至7;
(3)乳酸乙酯分子的結構簡式為CH3CH(OH)COOCH2CH3,分子中有5種不同環境的氫原子,乳酸乙酯分子核磁共振氫譜中有5個峰,
故答案為:5.
點評 本題考查有機物制備實驗,涉及酯化反應、物質的分離提純、平衡移動原理應用、對信息的獲取與運用、實驗基本操作、核磁共振氫譜等,難度中等.


 輕巧奪冠周測月考直通名校系列答案
輕巧奪冠周測月考直通名校系列答案科目:高中化學 來源: 題型:選擇題
| A. | 從碘水中提取單質碘時,不能用無水乙醇代替CCl4 | |
| B. | 利用重結晶可對粗苯甲酸進行提純 | |
| C. | 不能用核磁共振氫譜來鑒別1-溴丙烷和2-溴丙烷 | |
| D. | 實驗室中提純混有少量乙酸的乙醇,可采用先加生石灰,過濾后再蒸餾的方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
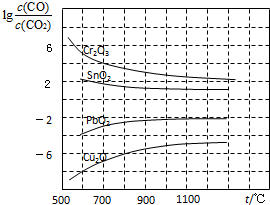 數十年來,化學工作者對碳的氧化物做了廣泛深入的研究并取得了一些重要成果.
數十年來,化學工作者對碳的氧化物做了廣泛深入的研究并取得了一些重要成果.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在0.1mol/L Na2CO3溶液中,CO32-的數目小于0.1NA個 | |
| B. | 標準狀況下,6.0 g乙酸含有0.3 NA個C-H鍵 | |
| C. | 32gCu與足量硫黃充分反應,轉移NA個電子 | |
| D. | 31g白磷(P4)中含有6 NA個共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
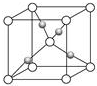 Al、Ti、Fe、Cu是幾種常見的重要金屬.根據要求回答下列問題:
Al、Ti、Fe、Cu是幾種常見的重要金屬.根據要求回答下列問題:| 元素 | A | B | |
| 電離能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物質的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入水時,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低溫度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固體,平衡向左移動,電離平衡常數減小 | |
| D. | 加入少量0.1 mol•L-1 鹽酸,溶液中c(OH-)增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 反應時間/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反應在t1min內的平均速率為v(H2)=$\frac{0.40}{t_1}$mol/(L•min) | |
| B. | 保持其他條件不變,起始時向容器中充入0.60molCO和1.20molH2O,到達平衡時n(CO2)=0.40 mol | |
| C. | 保持其他條件不變,向平衡體系中再通入0.20molH2O,與原平衡相比,達到新平衡時CO轉化率增大,H2O的體積分數減小 | |
| D. | 溫度升至1000℃,上述反應平衡常數為1.6,則正反應為放熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
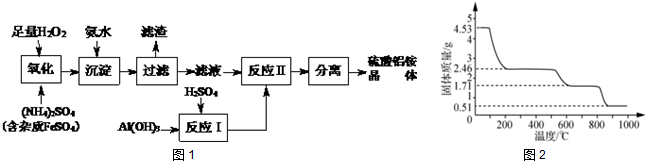
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com