
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物質的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
分析 A.Na2S是強堿弱酸鹽,硫離子兩步水解都生成OH-,但其第一步水解程度遠遠大于第二步水解程度;
B.CO32-水解生成HCO3-,所以溶液中還存在HCO3-,任何電解質溶液中都存在電荷守恒,根據電荷守恒判斷;
C.氯水中存在Cl2+H2O?H++Cl-+HClO、HClO?H++ClO-,且HClO電離程度較小;
D.任何電解質溶液中都存在物料守恒,根據物料守恒判斷.
解答 解:A.Na2S是強堿弱酸鹽,硫離子兩步水解都生成OH-,但其第一步水解程度遠遠大于第二步水解程度,所以離子濃度大小順序是c(Na+)>c(OH-)>c(HS-)>c(H2S),故A錯誤;
B.CO32-水解生成HCO3-,所以溶液中還存在HCO3-,任何電解質溶液中都存在電荷守恒,根據電荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故B錯誤;
C.氯水中存在Cl2+H2O?H++Cl-+HClO、HClO?H++ClO-,HClO電離程度大于水的電離程度,但HClO電離程度較小,HCl、HClO都電離生成氫離子,離子濃度大小順序是c(H+)>c(Cl-)>c(ClO-)>c(OH-),故C錯誤;
D.任何電解質溶液中都存在物料守恒,根據物料守恒得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)=2c(Na+),故D正確;
故選D.
點評 本題考查離子濃度大小比較,為高頻考點,側重考查學生分析判斷能力,把握溶液中溶質及其性質是解本題關鍵,注意C中存在的兩個電離平衡,為易錯點.


 步步高達標卷系列答案
步步高達標卷系列答案科目:高中化學 來源: 題型:解答題
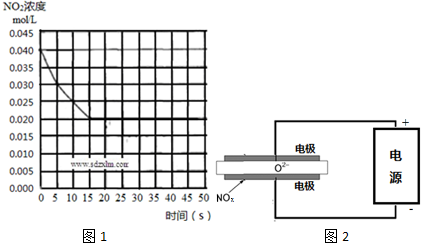
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿性氧化物均為金屬氧化物 | |
| B. | 一種元素可能有多種氧化物,但是同種化合價只對應一種氧化物 | |
| C. | 酸根離子中不可能含有金屬元素 | |
| D. | 還原產物只有還原性,氧化產物只有氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
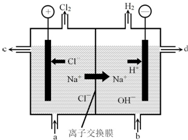 氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品.
氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
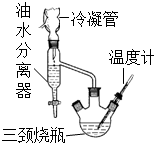 乳酸乙酯(2-羥基丙酸乙酯)常用于調制果香型、乳香型食用和酒用香精.為了在實驗室制取乳酸乙酯,某研究性學習小組同學首先查閱資料,獲得下列信息:
乳酸乙酯(2-羥基丙酸乙酯)常用于調制果香型、乳香型食用和酒用香精.為了在實驗室制取乳酸乙酯,某研究性學習小組同學首先查閱資料,獲得下列信息:| 物質 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸點/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用水溶解后過濾分離 | B. | 用稀鹽酸溶解過濾分離 | ||
| C. | 用稀硫酸溶解過濾分離 | D. | 用酒精燈加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | 相關信息 |
| X | X的基態原子核外3個能級上有電子,且每個能級上的電子數相等 |
| Y | M層上有2對成對電子 |
| Z | Z和Y同周期,Z的電負性大于Y |
| W | W的一種核素的質量數為63,中子數為34 |
| J | J的氣態氫化物與J的最高價氧化物對應的水化物可反應生成一種鹽 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應的氧化劑是H2C2O4 | B. | 1molMnO4-在反應中失去5mol電子 | ||
| C. | 從反應中看出草酸性質很不穩定 | D. | 配平該反應后,H+的計量數是6 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com