
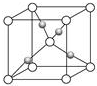
 Al、Ti、Fe、Cu是幾種常見的重要金屬.根據要求回答下列問題:
Al、Ti、Fe、Cu是幾種常見的重要金屬.根據要求回答下列問題:| 元素 | A | B | |
| 電離能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
分析 (1)由反應物、生成物可知化學反應;
(2)Fe的原子序數為26,位于第ⅤⅢ族,3d電子半滿為穩定結構;
(3)[Cu(NH3)4]SO4•H2O中[Cu(NH3)4]2+為平面正四邊形結構,水為V型,SO42-中S為sp3雜化,且不存在孤對電子,N為sp3雜化,有1對孤對電子;
(4)由均攤法計算氧化亞銅晶胞中Cu原子和O原子的數目,根據密度計算公式ρ=$\frac{m}{V}$計算即可.
解答 解:(1)鋁粉與石墨、TiO2高溫下反應生成TiC和另外一種耐高溫物質X,結合原子守恒可知反應為4Al+3C+3TiO2$\frac{\underline{\;高溫\;}}{\;}$3TiC+2Al2O3,
故答案為:4Al+3C+3TiO2$\frac{\underline{\;高溫\;}}{\;}$3TiC+2Al2O3;
(2)Fe的原子序數為26,位于第ⅤⅢ族,Fe原子的價電子排布式為3d64s2,氣態Mn2+再失去一個電子比氣態Fe2+再失去一個電子難,可知Mn易失去2個電子達到3d電子半滿的穩定結構,而Fe失去2個電子達到3d電子半滿的穩定結構,B為Fe的電離能數據,
故答案為:3d64s2;B;
(3)[Cu(NH3)4]SO4•H2O中[Cu(NH3)4]2+為平面正四邊形結構,水為V型,SO42-中S為sp3雜化,且不存在孤對電子,為正四面體結構;含5個原子且價電子數為32的等電子體的分子為SiF4、CCl4(GeCl4);N形成3個單鍵,且有1對孤對電子,N為sp3雜化,
故答案為:SO42-;SiF4、CCl4(GeCl4);sp3;
(4)由Cu2O的晶胞結構圖可知,白球為1+8×$\frac{1}{8}$=2個,黑球為4個,則黑球為Cu+,Cu+周圍有2個氧離子,則Cu+的配位數為2;該晶胞的邊長為a pm,則Cu2O的密度為$\frac{\frac{144g/mol×2}{{N}_{A}}}{(a×1{0}^{-10}cm)^{3}}$=$\frac{288×1{0}^{30}}{{a}^{3}×{N}_{A}}$ g/cm3,故答案為:$\frac{288×1{0}^{30}}{{a}^{3}×{N}_{A}}$ g/cm3.
點評 本題考查晶胞計算及原子結構,為高頻考點,把握晶體計算及雜化理論、電離能等為解答的關鍵,側重原子結構與性質的考查,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 少量NaHCO3與過量Ca(OH)2反應:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 在CuSO4溶液中加Ba(OH)2溶液 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2S溶液中通入H2S氣體 S2-+H+═HS- | |
| D. | NaHCO3溶液與KHSO4溶液反應 HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 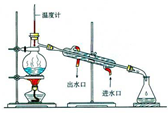 用如圖裝置分離甲苯和水 | |
| B. | 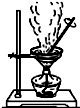 蒸干NH4Cl溶液制備NH4Cl晶體 | |
| C. | 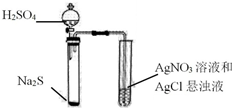 證明Ag2S溶解度小于AgCl | |
| D. | 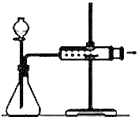 關閉分液漏斗活塞,向外拉動針筒活塞,松開后活塞恢復原位置,證明裝置氣密性良好 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
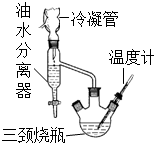 乳酸乙酯(2-羥基丙酸乙酯)常用于調制果香型、乳香型食用和酒用香精.為了在實驗室制取乳酸乙酯,某研究性學習小組同學首先查閱資料,獲得下列信息:
乳酸乙酯(2-羥基丙酸乙酯)常用于調制果香型、乳香型食用和酒用香精.為了在實驗室制取乳酸乙酯,某研究性學習小組同學首先查閱資料,獲得下列信息:| 物質 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸點/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 右 (M+2Q) | B. | 左 (M+2Q) | C. | 右 (M+4Q) | D. | 左 (M+4Q) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al3+ | B. | Al(OH)3 | C. | AlO2- | D. | Al3+ Al(OH)3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com