
| 0.1b-0.01a |
| a+b |
| 0.05×2 |
| 2+9 |


 口算能手系列答案
口算能手系列答案科目:高中化學 來源: 題型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 時間(min) | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| 濾紙 條的 顏色 變化 | 玻璃片I上的濾紙條 | 白色 | 白色 | 灰色 | 淺藍色 | 藍色 | 藍色 | 淺藍色 |
| 玻璃片II上的濾紙條 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 淺藍色 | |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、研究可降解高分子材料,較少使用塑料制品 |
| B、倡導低碳經濟,減少對化石燃料的依賴 |
| C、通過燃煤固硫、汽車尾氣凈化提高空氣質量 |
| D、采用露天焚燒或深埋的方法處理所有垃圾 |
查看答案和解析>>
科目:高中化學 來源: 題型:
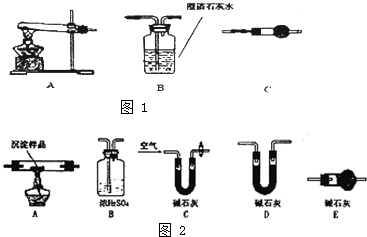 某研究性學習小組將一定濃度Na2CO3溶液滴入CuSO4溶液中得到藍色沉淀.
某研究性學習小組將一定濃度Na2CO3溶液滴入CuSO4溶液中得到藍色沉淀.查看答案和解析>>
科目:高中化學 來源: 題型:
| A、△H1=-178.32 kJ?mol-1△H2=-78.3 kJ?mol-1 |
| B、△H1=+178.32 kJ?mol-1△H2=-78.3 kJ?mol-1 |
| C、△H1=-178.32 kJ?mol-1△H2=+78.3 kJ?mol-1 |
| D、△H1=+178.32 kJ?mol-1△H2=+78.3 kJ?mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| 壓強/MPa 體積分數/% 溫度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、4個 | B、3個 | C、2個 | D、1個 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 如圖是硫酸的試劑標簽上的部分內容.某次學生實驗需要0.5mol?L-1 H2SO4溶液480mL,若由你來配制所需溶液,請根據實驗室已有的儀器和藥品情況回答下列問題:
如圖是硫酸的試劑標簽上的部分內容.某次學生實驗需要0.5mol?L-1 H2SO4溶液480mL,若由你來配制所需溶液,請根據實驗室已有的儀器和藥品情況回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com