
| A、△H1=-178.32 kJ?mol-1△H2=-78.3 kJ?mol-1 |
| B、△H1=+178.32 kJ?mol-1△H2=-78.3 kJ?mol-1 |
| C、△H1=-178.32 kJ?mol-1△H2=+78.3 kJ?mol-1 |
| D、△H1=+178.32 kJ?mol-1△H2=+78.3 kJ?mol-1 |


 導學教程高中新課標系列答案
導學教程高中新課標系列答案科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| 實驗序號 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3標準溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |

查看答案和解析>>
科目:高中化學 來源: 題型:
| A、Al-Mg合金焊接過程中使用的保護氣為N2 |
| B、工業上可采用電解熔融NaCl的方法制備金屬鈉 |
| C、將0.5molN2和1.5molH2充入一密閉容器中充分反應,放出熱量19.6KJ,則該熱化學方程式為N2(g)+3 H2(g)?2NH3(g)△H=-39.2 KJ?mol-1 |
| D、已知:2H2(g)+O2(g)?2H2O(g)△H=-486 KJ?mol-1,則H2的燃燒熱△H為-243 KJ?mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
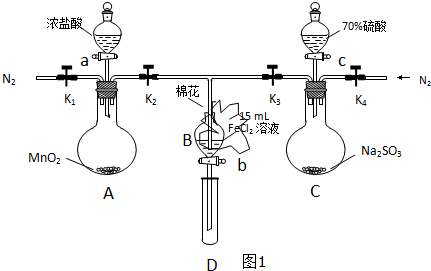
| 過程ⅣB溶液中含有的離子 | 過程ⅥB溶液中含有的離子 | |
| 甲 | 有Fe3+無Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+無Fe2+ | 有Fe2+ |
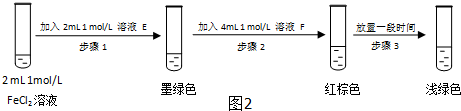
查看答案和解析>>
科目:高中化學 來源: 題型:

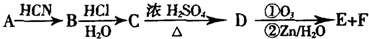
查看答案和解析>>
科目:高中化學 來源: 題型:
| M |
| M |
| 選 項 | X | Y | Z | M |
| A | NH3 | NO | NO2 | O2 |
| B | NaOH | Na2SO3 | NaHSO3 | SO2 |
| C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
| D | Mg | C | CO | CO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、小于0.2mol |
| B、0.2mol |
| C、0.4mol |
| D、0.2mol和0.4mol之間 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com