
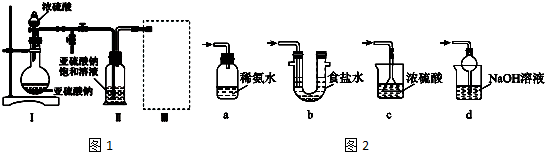

分析 (1)由裝置Ⅱ中發生的反應可知,裝置Ⅰ中產生的氣體為SO2,亞硫酸鈉與硫酸反應生成硫酸鈉、二氧化硫與水;
(2)根據裝置圖可知盛裝濃硫酸的儀器名稱;
(3)裝置Ⅲ用于處理尾氣,吸收為反應的二氧化硫,應防止倒吸,且不能處于完全密閉環境中;
(4)NaHSO3溶液中HSO3-的電離程度大于水解程度,溶液呈酸性,故檢驗溶液呈酸性即可;
(5)Na2S2O5晶體在空氣中易被氧化為Na2SO4,用鹽酸、氯化鋇溶液檢驗樣品中是否含有硫酸根即可;
(6)①碘具有氧化性,能氧化乳膠管,所以要用酸式滴定管;
②碘遇淀粉顯藍色,據此選擇指示劑;
③用標準I2溶液滴定時,達到滴定終點,溶液中有碘單質,遇淀粉顯藍色;
④若有部分HI被空氣氧化,則消耗碘的量偏小,故測定二氧化硫的量偏小.
解答 解:(1)由裝置Ⅱ中發生的反應可知,裝置Ⅰ中產生的氣體為SO2,亞硫酸鈉與硫酸反應生成硫酸鈉、二氧化硫與水,反應方程式為:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案為:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)根據裝置圖可知盛裝濃硫酸的儀器名稱為分液漏斗,
故答案為:分液漏斗;
(3)a.裝置應將導管深入氨水中可以吸收二氧化硫,但為密閉環境,裝置內壓強增大易產生安全事故,故錯誤;
b.該裝置吸收二氧化硫能力較差,且為密閉環境,裝置內壓強增大易產生安全事故,故錯誤;
c.該裝置不能吸收二氧化硫,所以無法實現實驗目的,故錯誤;
d.該裝置中氫氧化鈉與二氧化硫反應,可以吸收,且防止倒吸,故正確;
故答案為:d;
(4)NaHSO3溶液中HSO3-的電離程度大于水解程度,溶液呈酸性,測定溶液的pH,可以確定溶液酸堿性,酸性溶液可以使濕潤藍色石蕊試紙變紅,所以能用測定溶液pH值、濕潤的藍色石蕊試液檢驗,而加入Ba(OH)2溶液、HCl溶液、品紅溶液都不能說明溶液呈酸性,故選ae;
故答案為:ae;
(5)Na2S2O5中S元素的化合價為+4價,因此會被氧化為為+6價,即晶體在空氣中易被氧化為Na2SO4,用鹽酸、氯化鋇溶液檢驗樣品中是否含有硫酸根即可,實驗方案為:取少量Na2S2O5晶體于試管中,加入適量水溶解,滴加鹽酸,振蕩,再滴加氯化鋇溶液,有白色沉淀生成,
故答案為:取少量Na2S2O5晶體于試管中,加入適量水溶解,滴加鹽酸,振蕩,再滴加氯化鋇溶液,有白色沉淀生成;
(6)①碘具有氧化性,能氧化乳膠管,所以要用酸式滴定管,
故答案為:酸式;
②碘遇淀粉顯藍色,所以該滴定實驗所用的指示劑為淀粉溶液,
故答案為:淀粉溶液;
③用標準I2溶液滴定時,達到滴定終點,溶液中有碘單質,遇淀粉顯藍色,所以滴定終點的現象 為當滴入最后一滴碘水溶液,溶液由無色變為藍色,且半分鐘不褪色,
故答案為:當滴入最后一滴碘水溶液,溶液由無色變為藍色,且半分鐘不褪色;
④若有部分HI被空氣氧化,則消耗碘的量偏小,故測定二氧化硫的量偏小,則測定結果偏低,
故答案為:偏低.
點評 本題考查物質的制備實驗、實驗方案設計、物質含量的測定、氧化還原反應滴定等,難度中等,明確實驗原理是解本題關鍵,根據物質的性質分析解答,注意元素化合物知識的積累和靈活運用.


科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4LCl2完全反應轉移電子數一定為2×6.02×1023 | |
| B. | 因SO2具有漂白性,故可使品紅溶液、酸性KMnO4溶液褪色 | |
| C. | 常溫下,$\frac{c(OH-)}{c(H+)}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存 | |
| D. | 將20.0gNaOH固體置入500mL容量瓶,然后加水至刻度線即得1.00mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合氣體中NO與O2的體積之比為4:1 | |
| B. | 水吸收后的剩余氣體是O2,且c=$\frac{a}{6}$ | |
| C. | 取m g AgNO3溶于水再加足量鹽酸可生成沉淀$\frac{2a}{3×22.4}$×143.5g | |
| D. | 水吸收后所得溶液中HNO3的物質的量濃度為$\frac{b}{108}$mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| a | b | c | |
| A | 2 | 1 | 1 |
| B | 1 | 1 | 0 |
| C | 1 | 0 | 1 |
| D | 0 | 1 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二上第一次月考化學卷(解析版) 題型:填空題
將物質的量均為3.00mol物質A、B混合于5L容器中,發生如下反應 3A+B 2C,在反應過程中C的物質的量分數隨溫度變化如圖所示:
2C,在反應過程中C的物質的量分數隨溫度變化如圖所示:
(1)T0對應的反應速率v正__________v逆。(填“>”“<”或“=”);
(2)此反應的正反應為___________熱反應。(填“吸”或“放”);
(3)X、Y兩點A物質正反應速率的大小關系是Y___________X;(填“>”“<”或“=”);
(4)若Y點的C的物質的量分數為25%,則參加反應的A的物質的量為____________mol;若Y點時所耗時間為2min,則B物質的反應速率為__________mol/(L·min)。
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4種 | B. | 6種 | C. | 7種 | D. | 8種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學反應 | 平衡常數 | 溫度 | |
| 973K | 1173K | ||
| ⅠFe(s)+CO2(g)=FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ⅡFe(s)+H2O(g)=FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ⅢCO(g)+H2O(g)=CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na放置在空氣中生成淡黃色的Na2O2固體 | |
| B. | Fe在O2中燃燒產物可用于制紅色涂料 | |
| C. | Na、Al、Cu可以分別用電解冶煉法、熱還原法和熱分解法得到 | |
| D. | FeCl2溶液中滴加氨水至過量,加熱蒸干溶液,最后灼燒可得到Fe2O3固體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com