
下列實驗操作和理象、結論均正確且有因果關系的是
選項 | 實驗操作和現象 | 結論 |
A | 向某溶液中滴加CCl4,振蕩、靜置,下層溶液顯紫色 | 原溶液中含有I- |
B | 常溫下,0.1mol/LNaHSO3溶液的pH約為5 | HSO3-的電離程度大于其水解程度 |
C | 相同溫度下,測得飽和亞硫酸溶液的pH小于飽和碳酸溶液的pH | 亞硫酸的酸性強于碳酸 |
D | 向稀HNO3中加入過量的Fe粉,充分反應后,滴入KSCN溶液不顯紅色 | 稀HNO3將Fe氧化為Fe2+ |
A. A B. B C. C D. D
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2016-2017學年甘肅省天水市高二下學期開學考試(寒假作業檢測)化學試卷(解析版) 題型:選擇題
在一定溫度下,下列敘述是可逆反應A(g)+3B(g) 2C(g)在定容密閉容器中達到平衡的標志的是
2C(g)在定容密閉容器中達到平衡的標志的是
①C的生成速率與C的分解速率相等;
②單位時間內amol A生成,同時生成3amol B;
③A、B、C的濃度不再變化;
④混合氣體的總壓強不再變化;
⑤混合氣體的平均摩爾質量不再變化;
⑥用A、B、C的物質的量濃度變化表示的反應速率之比為1:3:2;
⑦A、B、C的分子數目比為1:3:2;
⑧混合氣體的密度不再變化。
A. ②⑤ B. ①③④⑤ C. ②⑥⑦⑧ D. ⑤⑥⑧
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省莊河市高一上學期期末考試化學試卷(解析版) 題型:選擇題
下列化合物中,可以通過置換反應一步得到的是( )
①FeSO4 ②NaOH ③Fe3O4 ④Al2O3
A. ①②③④ B. ①②③ C. ①④ D. ①③
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省高三2月份模擬演練理綜化學試卷(解析版) 題型:選擇題
常溫下,0.1000mol·L-1NaOH溶液分別滴定20.00mL濃度均為0.1000mol·L-1的兩種一元酸HX、HY溶液,滴定曲線如圖所示。下列說法正確的是
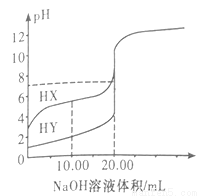
A. HX是強酸,HY是弱酸
B. V[NaOH(aq)]=10.00mL時,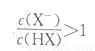
C. V[NaOH(aq)]=20.00mL時,所得的兩種溶液的pH均等于7
D. V[NaOH(aq)]=20.00mL時,所得的兩種溶液的導電性,HX的比HY的強
查看答案和解析>>
科目:高中化學 來源:2017屆山東省淄博市高三第一次模擬考試化學試卷(解析版) 題型:實驗題
錳酸鋰(LiMn2O4)可作為鋰離子電池的正極材料。工業上利用軟錳礦漿吸收含硫煙氣(SO2 和O2)制備錳酸鋰,生產流程如下:
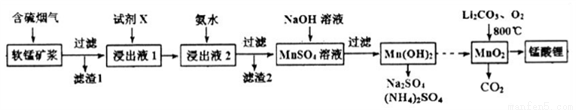
已知:①軟錳礦主要成分為MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等雜質。
②軟錳礦漿在吸收含硫煙氣的過程中酸性逐漸增強。
③部分氫氧化物沉淀相關的溶液pH如下表:
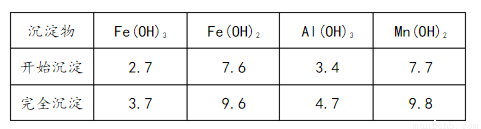
(1)已知:
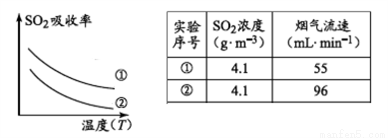
下列措施可提高SO2吸收率的是__________(填序號)
a.降低通入含硫煙氣的溫度 b.升高通入含硫煙氣的溫度
c.減少軟錳礦漿的進入量 d.減小通入含硫煙氣的流速
(2)加入試劑X能提高產品純度,則X可以是_____________(填化學式)
(3)加氨水調溶液pH在5~6之間,目的是_______________。
(4)錳酸鋰可充電電池的總反應式為:Li1-xMnO2+LixC  LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
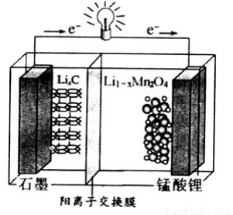
①放電時,電池的正極反應式為__________________
②充電時,若轉移1mole-,則石墨電極將增重__________g。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省鹽城市高二學業水平模擬(一)化學試卷(解析版) 題型:簡答題
KIO3是一種無色易溶于水的晶體,醫藥上可作防治地方甲狀腺腫的藥劑,目前碘酸鉀被廣泛應用于食鹽加碘。一種由含碘廢水制取碘酸鉀的工藝如下:
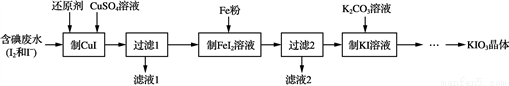
(1) 檢驗“含碘廢水”中含有的單質I2,常用的試劑是________。
(2) 進行“過濾1”時,需同時對CuI沉淀進行洗滌。在洗滌過濾濾液中可通過滴加________鹽溶液來檢驗其是否已洗滌干凈。
(3) “濾渣2”的成分為____________(填化學式)。
(4) “制KI”時,發生反應的化學方程式為____________。
(5) 江蘇食用加碘鹽新標準是每千克食鹽中碘元素含量為25毫克(波動范圍為18~33 mg/kg)。測定食鹽試樣中碘元素含量的步驟如下:稱取4.000 g市售食鹽加入錐形瓶中,依次加入適量的水、稍過量KI及稀硫酸;充分反應后,再加入12.00 mL 6.000×10-4 mol·L-1 Na2S2O3溶液,與生成的碘恰好完全反應。有關反應原理為:
KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O; I2+2S2O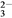 ===2I-+S4O
===2I-+S4O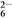 。
。
①計算該食鹽試樣中碘元素的含量(單位mg/kg,寫出計算過程)。
_______
②該食鹽試樣是否符合江蘇食用加碘鹽新標準并說明判斷依據。
_______
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省鹽城市高二學業水平模擬(一)化學試卷(解析版) 題型:選擇題
用蘸有濃氨水的棉棒檢漏輸氯管道的原理為:3Cl2+8NH3=N2+6NH4Cl。該反應的下列說法正確的是( )
A. 35.5 g氯氣所含的分子數為6.02×1023
B. 常溫常壓下,22.4 L氨氣所含原子總數為4×6.02×1023
C. 反應每生成1 mol N2轉移電子數約為6×6.02× 1023
D. 1 mol·L-1 NH4Cl溶液中,含有Cl-數約為6.02×1023
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省鹽城市高二學業水平模擬(一)化學試卷(解析版) 題型:選擇題
我國首飛的長征七號運載火箭采用液氧和煤油作為推進劑。煤油屬于( )

A. 純凈物 B. 混合物 C. 氧化物 D. 單質
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省常州市高三第一次模擬考試化學試卷(解析版) 題型:填空題
堿式次氯酸鎂[Mga(ClO)b(OH)c·xH2O]是一種有開發價值的微溶于水的無機抗菌劑。為確定堿式次氯酸鎂的組成,進行如下實驗:
① 準確稱取1.685g堿式次氯酸鎂試樣于250mL錐形瓶中,加入過量的KI溶液,用足量乙酸酸化,用O.8000mol/LNa2S2O3標準溶液滴定至終點(離子方程式為2S2O32-+I2=2I-+S4O62-),消耗25.00mL。
② 另取1.685g堿式次氯酸鎂試樣,用足量乙酸酸化,再用足量3%H2O2溶液處理至不再產生氣泡(H2O2被ClO-氧化為O2),稀釋至1000mL。移取25.00mL溶液至錐形瓶中,在一定條件下用0.020 00mol/L EDTA(Na2H2Y)標準溶液滴定其中的Mg2+(離子方程式為Mg2++H2Y2-=MgY2-+2H+) ,消耗25.00 mL
(1)步驟① 中需要用到的指示劑是_______。
(2)步驟② 中若滴定管在使用前未用EDTA標準溶液潤洗,測得的Mg2+物質的量將____(填“偏高”、“偏低”或“不變”)。
(3)通過計算確定堿式次氯酸鎂的化學式(寫出計算過程)。____
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com