
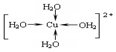
 .
. 分析 (1)①CO中C與O以三鍵結合在一起;價電子數相同、原子數相同的微粒為互為等電子體;
②根據相似相溶原理分析;
(2)根據核外電子排布式的書寫規則書寫;根據價電子排布判斷電離能的大小;
(3)根據價層電子對互斥理論來判斷;
(4)①Fe(CO)5常溫下呈液態,熔沸點較低,應為分子晶體;
②CuSO4•5H2O中銅離子含有空軌道,水分子含有孤對電子對,銅離子與水分子之間形成配位鍵,銅離子配體數為4.
解答 解:(1)①CO分子中C原子上有一對孤對電子,C、O原子都符合8電子穩定結構,則CO的結構式為C≡O,等電子體中原子數和價電子數都相同,則 N2、CN-、CO的原子數都是2,價電子數都是10,則互為等電子體,
故答案為:C≡O;CN-;
②Ni(CO)4中Ni采取SP3雜化,是正四面體結構,所以屬于非極性分子,根據相似相溶原理,非極性溶質易溶于非極性溶劑,苯和四氯化碳是非極性分子,所以Ni(CO)4易溶于苯和四氯化碳,
故答案為:bc;
(2)鎵是31號元素,該原子核外有31個電子,4S能級能量小于3d能級能量,根據能量最低原理,電子先排4s能級后排3d能級,所以銅的核外電子排布式為1s22s22p63s23p63d104s24p1;Zn原子的價電子排布式為3d104s2,價電子中3d、4s軌道為全充滿狀態,原子較穩定,故Zn的第一電離能大于Ga,
故答案為:1s22s22p63s23p63d104s24p1;Zn原子的價電子排布式為3d104s2,體系的能量較低,原子較穩定,故Zn的第一電離能大于Ga;
(3)H2S分子的中心原子S原子上含有2個σ 鍵,中心原子上的孤電子對數=$\frac{6+1×2}{2}$=4,所以硫化氫分子的VSEPR模型是四面體型,略去孤電子對后,實際上其空間構型是V型;BF3分子的中心原子B原子上含有3個σ 鍵,中心原子上的孤電子對數=$\frac{3+1×3}{2}$=3,所以BF3分子的VSEPR模型是平面三角型,中心原子上沒有孤對電子,所以其空間構型就是平面三角形.
故選:d;
(4)①Fe(CO)5常溫下呈液態,熔沸點較低,易溶于非極性溶劑,應為分子晶體,
故答案為:分子晶體;
②CuSO4•5H2O中銅離子含有空軌道,水分子含有孤對電子對,銅離子與水分子之間形成配位鍵,銅離子配體數為4.水合銅離子的結構簡式為 .
.
故答案為: .
.
點評 本題綜合性較強,涉及分子的結構、晶體與化學鍵、核外電子排布規律、雜化類型的判斷、配位鍵等,題目難度中等,是對所學知識及學生能力的綜合考查.注意分子立體構型以及雜化類型的判斷,為物質結構與性質模塊的考查熱點.


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:高中化學 來源: 題型:解答題
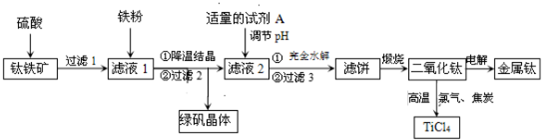
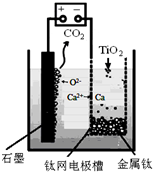
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
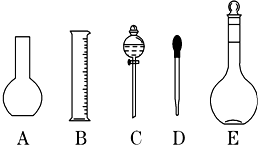
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等物質的量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量多 | |
| B. | 由C(石墨)=C(金剛石);△H=+1.90 kJ•mol-1可知,金剛石比石墨穩定 | |
| C. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,若將含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的溶液混合,放出的熱大于57.3 kJ | |
| D. | 在101 kPa時,2 g H2 完全燃燒生成液態水,放出285.8 kJ熱量,氫氣燃燒的熱化學方程式表示為:2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋁的密度小 | B. | 鋁表面能形成致密的氧化膜 | ||
| C. | 常溫下鋁不能與氧氣反應 | D. | 鋁的化學性質不活潑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鋁溶于氫氧化鈉溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 過氧化鈉與水反應:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | FeCl2溶液跟Cl2反應:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+ K+ SO42- AlO2- | B. | Ca2+ Na+ SO42- Cl- | ||
| C. | Na+ K+ SO42- NO3- | D. | K+ Na+ MnO4- SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
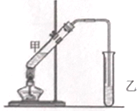 酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如下圖所示的裝置制取乙酸乙酯.回答下列問題:
酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如下圖所示的裝置制取乙酸乙酯.回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com