
(13分)在固定容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g) 2NO2(g)隨溫度升高,混合氣體的顏色變深。回答下列問題:
2NO2(g)隨溫度升高,混合氣體的顏色變深。回答下列問題:
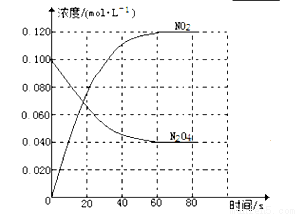
(1)反應的△H 0(填“大于”“小于”);100℃時,體系中各物質濃度隨時間變化如上圖所示。在0~60s時段,反應速率v(N2O4)為 。 反應的平衡常數K1= 。
(2)100℃時達到平衡后,改變反應溫度為T,c(N2O4)降低,經10s又達到平衡。
①T 100℃(填“大于”“小于”),判斷理由是 。
②100℃時達到平衡后,向容器中再充入0.20mol NO2氣體,新平衡建立后,NO2的體積分數
(填“增大”、“不變”或“減小”)
(3)溫度T時反應達平衡后,將反應容器的容積減少一半,平衡向 (填“正反應”或“逆反應”)方向移動,判斷理由是 。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2015-2016學年重慶巴蜀中學高一上10月月考化學試卷(解析版) 題型:選擇題
2015年8月12日天津港危險品倉庫發生的爆炸事故,再次警示人們在注重提高科技化工發展水平的同時,不可忽視化學試劑存放的基本問題。下列在實驗室中關于試劑存放敘述正確的是

A.白磷不易揮發,不需要密閉存放;
B.氫氧化鈉溶液應保存在帶玻璃塞的細口試劑瓶中
C.氰化物的包裝標簽上應貼上如圖所示的標志
D.用容量瓶配制好溶液進行貯存時,需在容量瓶上貼上濃度標簽
查看答案和解析>>
科目:高中化學 來源:2015-2016學年北京大學附屬中學分校高一上抽考化學試卷(解析版) 題型:選擇題
下列反應中,氧化劑與還原劑的物質的量的關系為 1:2 的是
A.O3+2KI+H2O═2KOH+I2+O2
B.Ca(ClO)2+2CH3COOH═2HClO+Ca(CH3COO)2
C.I2+2NaClO3═2NaIO3+Cl2
D.4HCl(濃)+MnO2  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省高三上學期9月學情調研化學試卷(解析版) 題型:選擇題
下列各選項中,不能利用置換反應通過Y得到W的一組化合物是
選項 化合物 | A | B | C | D |
Y | CO2 | Fe2O3 | H2O | FeCl3 |
W | MgO | Al2O3 | HF | CuCl2 |
查看答案和解析>>
科目:高中化學 來源:2016屆廣東省高三上學期第二次教學質檢化學試卷(解析版) 題型:選擇題
向30mL 1mol/L的AlCl3溶液中逐漸加入濃度為4mol/L的NaOH溶液,若產生0.78g白色沉淀,則加入的NaOH溶液的體積可能為
A.3mL B.7.5mL C.15mL D.17.5mL
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川省高二10月月考化學試卷(解析版) 題型:選擇題
已知H2(g)+I2(g) 2HI(g) ΔH<0,有相同容積的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同溫度下分別達到平衡。欲使甲中HI的平衡濃度大于乙中HI的平衡濃度,應采取的措施是
2HI(g) ΔH<0,有相同容積的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同溫度下分別達到平衡。欲使甲中HI的平衡濃度大于乙中HI的平衡濃度,應采取的措施是
A.甲、乙提高相同溫度 B.甲中加入0.1mol He,乙不改變
C.甲降低溫度,乙不變 D.甲增加0.1molH2 ,乙增加0.1mol I2
查看答案和解析>>
科目:高中化學 來源:2016屆四川省雅安市高三9月月考化學試卷(解析版) 題型:實驗題
(本題共18分)配制480 mL 0.5 mol·L-1的NaOH溶液,試回答下列問題:
(1)選擇儀器:完成本實驗所必需的儀器有:托盤天平(精確到0.1 g)、藥匙、燒杯、玻璃棒、________、________等。
(2)計算、稱量:需稱量NaOH固體的質量為________。
(3)溶解、冷卻,該步實驗中需要使用玻璃棒,作用是___________________。
(4)轉移、洗滌。洗滌燒杯2~3次是為了______________________________。
(5)定容、搖勻。定容的具體操作是___________________________________。
(6)不規范的實驗操作會導致實驗結果的誤差,下列使所配溶液的物質的量濃度偏高的是 ,偏低的是 ,無影響的是 (填字母序號)。
A、容量瓶洗凈后未烘干;
B、在溶解過程中有少量液體濺出燒杯外
C、定容時俯視刻度線;
D、將稱量好的NaOH固體放入小燒杯中溶解,未經冷卻立即轉移到容量瓶中并定容
E、定容后,將容量瓶振蕩搖勻后,靜置發現液面低于刻度線,于是又加入少量水至刻度線
查看答案和解析>>
科目:高中化學 來源:2016屆四川省高三上學期第一次月考化學試卷(解析版) 題型:選擇題
化學與生活、社會密切相關。下列說法正確的是
A.金屬材料都是導體,非金屬材料都是絕緣體
B.硅材料廣泛用于光纖通訊
C.綠色食品是不含任何化學物質的食品
D.利用太陽能等清潔能源代替化石燃料,有利于節約資源、保護環境
查看答案和解析>>
科目:高中化學 來源:2016屆浙江省溫州市高三上學期返校聯考化學試卷(解析版) 題型:填空題
I.(7分)請回答:
(1)CO2的電子式 。
(2)鈉燃燒不能用CO2滅火,用化學方程式表示其理由 。
(3)重晶石(BaSO4)不溶于酸,用飽和Na2CO3處理轉化為易溶于酸的BaCO3,寫出反應的離子方程式 。
(4)完成以下氧化還原反應的離子方程式:
( )Cr2O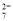 + ( )H2O2+ _____ =( ) Cr3++ ( ) O2 ↑ + ________
+ ( )H2O2+ _____ =( ) Cr3++ ( ) O2 ↑ + ________
II.(8分)化合物K3Fe(A2B4)3·3H2O是重要的催化劑。將化合物K3Fe(A2B4)3·3H2O受熱完全分解,只得到氣體產物和固體產物。經分析,氣體產物只有甲、乙和水蒸氣。已知甲、乙均由A、B兩元素組成,且摩爾質量:M(甲)<M(乙)。A元素的最外層電子數是次外層電子數2倍,B元素的主族序數是其所在周期數的3倍。經分析,固體產物只有Fe、FeO 和K2AB3。某同學再進行以下定量分析。
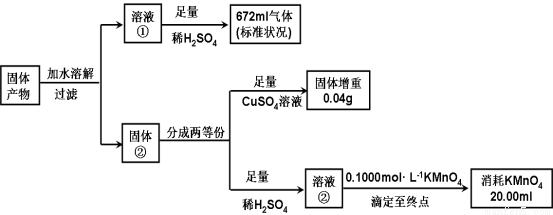
(1)甲的化學式: 。
(2)溶液②與KMnO4發生氧化還原的離子方程式: 。
(3)由以上實驗數據的分析可知n(Fe):n(FeO) :n(K2AB3) = : : 。
(4)某同學認為:溶液②由紫紅色變為無色,振蕩試樣半分鐘內不變色,即可證明溶液②與KMnO4溶液反應到達滴定終點。判斷該同學設想的合理性并說明理由 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com