
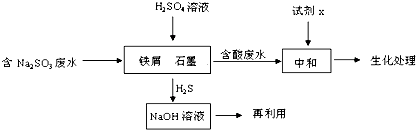
分析 (1)①Na2S為強堿弱酸鹽,S2-水解呈堿性;
②根據氧化還原反應中氧化劑和還原劑得失電子數目相等計算;溫度升高平衡常數增大,說明升高溫度平衡向正反應移動,則正反應吸熱;
(2)①H2S氣體與足量NaOH溶液反應反應生成Na2S和水;
②SO32-在酸性條件下放電生成H2S的過程為還原反應,根據反應物和生成物書寫電極反應式.
解答 解:(1)①Na2S為強堿弱酸鹽,S2-水解呈堿性,水解方程式為S2-+H2O?HS-+OH-,故答案為:S2-+H2O?HS-+OH-;
②1molNa2S轉化為1molNa2SO4,失去8mol電子,而1molO2被還原,得到4mol電子,所以還原劑與氧化劑的物質的量之比為1:2,溫度升高平衡常數增大,說明升高溫度平衡向正反應移動,則正反應吸熱,即△H>O,
故答案為:1:2;>;
(2)①H2S氣體與足量NaOH溶液反應反應生成Na2S和水,反應的化學方程式為H2S+2NaOH=Na2S+2H2O,故答案為:H2S+2NaOH=Na2S+2H2O;
②SO32-在酸性條件下放電生成H2S的過程為還原反應,電極反應式為SO32-+8H++6e-=H2S↑+3H2O,故答案為:SO32-+8H++6e-=H2S↑+3H2O.
點評 本題考查較為綜合,涉及鹽類的水解、氧化還原反應等問題,題目難度中等,本題注意把握水解的原理、氧化還原反應的計算以及電極反應式的書寫等方法性的問題.


科目:高中化學 來源: 題型:選擇題

| A. | ①圖象中如果縱坐標為正反應速率,則t時刻改變的條件可以為升溫或加壓 | |
| B. | ②圖象中縱坐標可以為鎵的轉化率 | |
| C. | ③圖象中縱坐標可以為化學反應速率 | |
| D. | ④圖象中縱坐標可以為體系內混合氣體平均相對分子質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿金屬氟化物的晶格能順序是LiF>NaF>KF>RbF>CsF;則鈉的鹵化物的晶格能順序是NaF>NaCl>NaBr>NaI | |
| B. | ⅣA族元素氫化物沸點順序是GeH4>SiH4>CH4;則ⅤA族元素氫化物沸點順序是AsH3>PH3>NH3 | |
| C. | 晶體中有陰離子,必有陽離子;則晶體中有陽離子,必有陰離子 | |
| D. | 若鹽酸的濃度是醋酸濃度的2倍;則鹽酸中H+濃度也是醋酸中H+濃度的2倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 難溶電解質 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全時的pH | 11.1 | 6.7 | 9.6 | 3.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3:2 | B. | 1:6 | C. | 2:3 | D. | 1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 下列各組物質中,物質之間通過一步反應就能實現如圖所示轉化的是( )
下列各組物質中,物質之間通過一步反應就能實現如圖所示轉化的是( )| a | b | c | |
| A | N2 | NO | NO2 |
| B | S | SO2 | SO3 |
| C | Si | SiO2 | H2SiO3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com