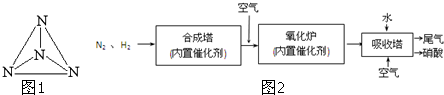
考點:化學方程式的有關計算,化學平衡的影響因素,等效平衡,化學平衡的計算,難溶電解質的溶解平衡及沉淀轉化的本質,二氧化硫的化學性質
專題:計算題,化學平衡專題
分析:(1)SO
2和Cl
2組成的混合氣體通入Fe
2(SO
4)
3溶液中,由于氯氣的氧化性強于鐵離子,故氯氣先與二氧化硫反應:SO
2+Cl
2+2H
2O=2HCl+H
2SO
4,充分反應后,溶液的棕黃色變淺,說明鐵離子氧化二氧化硫:2Fe
3++SO
2+H
2O=SO
42-+2Fe
2++2H
+,二氧化硫完全反應,反應后的溶液足量的BaCl
2溶液,生成的22.3g沉淀為BaSO
4,其物質的量為0.1mol,根據硫元素守恒可知n(BaSO
4)=3n[Fe
2(SO
4)
3]+n(SO
2),據此計算n(SO
2),進而計算二氧化硫的體積;
當鐵離子完全反應時,混合氣體的體積最最小,計算Fe
3+離子氧化的SO
2,剩余的SO
2由氯氣氧化,進而計算混合氣體最小體積;當混合氣體SO
2和Cl
2恰好完全反應時,混合氣體的體積最大;
(2)根據熱化學方程式,可知每生成1mol SO
3放出98 kJ熱量,當放出196 kJ熱量時生成2 mol SO
3,利用三段式計算平衡時各組分的物質的量,根據K=
計算;
(3)溫度不變情況下,平衡常數不變,增大任一組分的濃度,平衡時各組分的濃度都增大;若只改變溫度,平衡常數分數變化,平衡時各組分的濃度,有的增大、有的減小;保持溫度和容器體積不變,充入不參與反應的氣體,平衡不移動,各組分的濃度不變;
(4)等體積混合后硫酸根為1.0×10
-3mol/L,根據溶度積計算Ba
2+離子最小濃度,進而計算BaCl
2溶液的最小濃度;
(5)SO
2的漂白原理是與有色物質化合生成無色不穩定的化合物,SO
2使酸性KMnO
4褪色,是SO
2表現還原性而不是漂白性;KMnO
4酸性條件下的還原產物為Mn
2+化合價降低5,SO
2被氧化成SO
42-化合價升高2,根據電子轉移守恒計算.
解答:
解:(1)SO
2和Cl
2組成的混合氣體通入Fe
2(SO
4)
3溶液中,由于氯氣的氧化性強于鐵離子,故氯氣先與二氧化硫反應:SO
2+Cl
2+2H
2O=2HCl+H
2SO
4,充分反應后,溶液的棕黃色變淺,說明鐵離子氧化二氧化硫:2Fe
3++SO
2+H
2O=SO
42-+2Fe
2++2H
+,二氧化硫完全反應,反應后的溶液足量的BaCl
2溶液,生成的16.31g沉淀為BaSO
4,其物質的量=
=0.1mol,根據硫元素守恒可知n(BaSO
4)=3n[Fe
2(SO
4)
3]+n(SO
2),故n(SO
2)=0.1mol-3×0.2L×0.1mol?L
-1=0.04mol,V(SO
2)=0.04mol×22.4L/mol=0.896L;
當鐵離子完全反應時,混合氣體的體積最小,n(Fe
3+)=2×0.2L×0.1mol?L
-1=0.04mol,可以氧化的SO
2為0.02mol,故被氯氣氧化SO
2為0.04mol-0.02mol=0.02mol,需要氯氣的物質的量為0.02mol,則混合氣體的最小體積大于(0.04mol+0.02mol)×22.4L/mol=1.344L,當混合氣體SO
2和Cl
2恰好完全反應時,混合氣體的體積最大,混合氣體的最大體積小于(0.04mol+0.04mol)×22.4L/mol=1.792L,故a的取值范圍為0.896<a<1.792,
故答案為:0.896;0.896<a<1.792;
(2)根據熱化學方程式每生成1mol SO
3放出98 kJ熱量,當放出196 kJ熱量時生成2 mol SO
3 SO
2(g)+
O
2(g)

SO
3(g)
初始(mol):4 10 0
變化(mol):2 1 2
平衡(mol):2 9 2
平衡常數k=
=
故答案為:
;
(3)A.保持溫度和容器體積不變,充入2mol SO
3,平衡向逆反應分析移動,則SO
2、O
2、SO
3氣體平衡濃度都比原來增大,故A正確;
B.保持溫度和容器體積不變,充入2mol N
2,對平衡移動沒有影響,各物質的濃度不變,故B錯誤;
C.保持溫度和容器體積不變,充入0.5mol SO
2和0.25mol O
2,平衡向正反應方向移動,則SO
2、O
2、SO
3氣體平衡濃度都比原來增大,故C正確;
D.保持溫度和容器內壓強不變,充入1mol SO
3,處于等效平衡狀態,濃度不變,故D錯誤;
E.升高溫度,平衡向逆反應分析移動,SO
3的濃度減小,故E錯誤;
F.移動活塞壓縮氣體,體積減小,各物質的濃度都增大,故F正確,
故答案為:A、C、F;
(4)等體積混合后硫酸根為1.0×10
-3mol/L,根據溶度積可知,Ba
2+離子最小濃度為
mol/L=1.08×10
-7mol/L,故BaCl
2溶液的最小濃度為1.08×10
-7mol/L×2=2.16×10
-7mol/L,
故答案為:2.16×10
-7mol/L;
(5)SO
2的漂白原理是與有色物質化合生成無色不穩定的化合物,SO
2使酸性KMnO
4褪色,是SO
2表現還原性而不是漂白性;KMnO
4酸性條件下的還原產物為Mn
2+化合價降低5,SO
2被氧化成SO
42-化合價升高2,根據電子轉移守恒,可得5x=2y,故x:y=5:2,
故答案為:5:2.
點評:本題比較綜合,涉及混合物計算、化學平衡常數計算、化學平衡影響因素、溶度積計算、氧化還原反應計算等,是對學生綜合能力的考查,(1)中注意利用極限法解答,難度中等.

 SO3(g)
SO3(g)

 、
、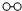 、
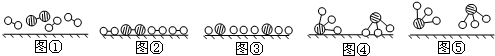
、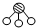 分別表示N2、H2、NH3.圖⑤表示生成的NH3離開催化劑表面.分別寫出圖②→③、圖③→④表示的變化過程
分別表示N2、H2、NH3.圖⑤表示生成的NH3離開催化劑表面.分別寫出圖②→③、圖③→④表示的變化過程