
| A. | 屬于金屬元素 | |
| B. | 質子數與中子數之差為50 | |
| C. | 原子的核外電子數是39 | |
| D. | ${\;}_{39}^{49}$Y和${\;}_{39}^{50}$Y是兩種不同的核素 |
分析 A.先根據構造原理判斷元素在周期表中的位置,然后判斷是否是金屬元素;
B.根據質子數、中子數、質量數之間的關系判斷;
C.根據原子的質子數與電子數的關系判斷;
D.具有一定數目質子和中子的原子稱為核素.
解答 解析:A、Y元素為39號元素,根據構造原理,核外電子排布式1S22S22P63S23P63d104S24P6 4d15S 2,字母前的數字表示電子層數,價電子是4d15S 2,價電子數之和=族序數,所以Y屬第五周期第ⅢB族,該元素是副族元素,所以是金屬元素,故A正確;
B、質子數+中子數=質量數,質子數-中子數=質子數-(質量數-質子數)=39-(59-39)=19.故B錯誤;
C、原子的核外電子數等于核內質子數,所以核外有39個電子,故C正確;
D、3949Y和3950Y是中子數不同的同一元素,所以是不同的兩種核素,故D正確.
故選:B.
點評 本題考查的是有關質子數、中子數、電子數之間的計算,以及同位素的定義,是小型綜合題,屬基礎知識的考查,難度不大.


 浙江名校名師金卷系列答案
浙江名校名師金卷系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①⑦ | C. | ④⑥⑦ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將含1mol FeCl3的飽和氯化鐵溶液逐滴加入沸水制備得到紅褐色氫氧化鐵膠體,其中含NA個Fe(OH)3膠粒 | |
| B. | 將80g NaOH溶于1L水中,所得溶液中NaOH的物質的量濃度為2 mol/L | |
| C. | 154g CCl4 在標準狀況下的體積是22.4L | |
| D. | 在標準狀況時,20ml NH3與60ml O2所含分子個數比為1:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 亞硝酸鈉大量用于染料和有機合成工業.用木屑制備亞硝酸鈉的流程如下:
亞硝酸鈉大量用于染料和有機合成工業.用木屑制備亞硝酸鈉的流程如下:
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
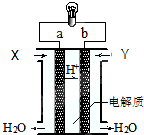
| A. | 正極的電極反應是:O2+2H2O+4e-=4OH- | |
| B. | a極是負極 | |
| C. | 電子由a通過燈泡流向b | |
| D. | 通入的氣體Y為O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇有還原性 | B. | 乙醇發生了加成反應 | ||
| C. | 乙醇密度比水小 | D. | 乙醇是烴的含氧化合物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com