
分析 (1)根據蓋斯定律,由已知熱化學方程式乘以適當的系數進行加減構造目標熱化學方程式;
(2)△G=△H-T△S<0時,反應自發進行;
(3)化學平衡常數,是指在一定溫度下,可逆反應達到平衡時各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值;
一般在過渡元素中需找合適的催化劑;
催化劑不影響化學平衡移動,說明催化劑同等程度改變正逆反應速率;
(4)原電池正極發生還原反應,二氧化碳與氧氣在正極通入,氧氣獲得電子生成碳酸根離子;
(5)由題目信息可知,二氧化碳與硫化氫反應得到(C6H10O3)n和淡黃色固體S,由C、O比例關系可知應有水生成,配平書寫方程式.
解答 解:(1)已知:①.CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ•mol-1
②.CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1
根據蓋斯定律,②-①可得:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1,
故答案為:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1;
(2)反應的△H=+247.4kJ•mol-1,△S=0.257kJ•mol-1•K-1,△G=△H-T△S<0時,反應自發進行,故247.4kJ•mol-1-T×0.257kJ•mol-1•K-1<0,解得T>926.6K,
故答案為:926.6K;
(3)反應CH4(g)+CO2(g)?2CO(g)+2H2(g)的平衡常數K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{H}_{4})×c(C{O}_{2})}$;一般在過渡元素中需找合適的催化劑;催化劑不影響化學平衡移動,說明催化劑同等程度改變正反應速率、逆反應速率,
故答案為:$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{H}_{4})×c(C{O}_{2})}$;過渡;催化劑不影響化學平衡移動,說明催化劑同等程度改變正反應速率、逆反應速率;
(4)原電池正極發生還原反應,二氧化碳與氧氣在正極通入,氧氣獲得電子生成碳酸根離子,電極反應式為:2CO2+O2+4e-=2CO32-,
故答案為:2CO2+O2+4e-=2CO32-;
(5)由題目信息可知,二氧化碳與硫化氫反應得到(C6H10O3)n和淡黃色固體S,由C、O比例關系可知應有水生成,該反應方程式為:6n CO2+12n H2S=(C6H10O3)n+12n S↓+7n H2O,
故答案為:6n CO2+12n H2S=(C6H10O3)n+12n S↓+7n H2O.
點評 本題屬于拼合型題目,涉及熱化學方程式書寫、反應自發性問題、平衡常數、催化劑對反應速率與化學平衡乙烯、原電池、化學方程式書寫等,需要學生具備扎實的基礎,難度中等.


科目:高中化學 來源: 題型:填空題
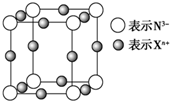
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 煤的干餾、石油的分餾都只發生了物理變化 | |
| B. | 棉、麻、絲、毛完全燃燒都只生成了CO2和H2O | |
| C. | 甲烷和苯都能發生取代反應 | |
| D. | 乙醇和乙酸互為同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
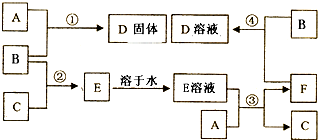
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2個 | B. | 3個 | C. | 4個 | D. | 5個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4Cl加熱分解只生成HCl和NH3,NH4I固體加熱分解也只生成HI和NH3 | |
| B. | 第二周期元素氫化物的穩定性順序是HF>H2O>NH3,則第三周期元素氫化物的穩定性順序也是:HCl>H2S>PH3 | |
| C. | 足量的CO2氣體通入Na2SiO3中可生成NaHCO3; 足量的CO2氣體通入石炭酸中也生成了NaHCO3 | |
| D. | 干冰(CO2)是分子晶體,則SiO2也是分子晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 20 mol•L-1•s-1 | B. | 40 mol•L-1•s-1 | C. | 60 mol•L-1•s-1 | D. | 150mol•L-1•s-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 、⑤ClCH=CHCl⑥
、⑤ClCH=CHCl⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨
、⑨

 (或
(或 )
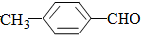
)

 溶解性由大到小的順序
溶解性由大到小的順序 >
> >
>
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 達到化學平衡時v正(O2)=v逆(NO) | |
| B. | 若單位時間內生成xmolNO的同時生成 xmolNH3,則反應達到平衡狀態 | |
| C. | 達化學平衡時,若增大容器體積,則正反應速率減小,逆反應速率增大 | |
| D. | 若反應發生在體積恒定的密閉容器中,當密度不變時,化學反應達到平衡狀態 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com