
| A. | Z的濃度可能為0.3mol/L | |
| B. | 平衡時X2、Y2的轉化率相等 | |
| C. | 平衡時,Y2和Z的生成速率之比為2:1 | |
| D. | 若平衡后再改變外界條件,升高溫度,則反應的平衡常數將變大 |
分析 A.X2的起始濃度分別為0.1mol/L,若完全轉化生成Z為0.2mol,該反應為可逆反應,則Z的濃度小于0.4mol;
B.Z的濃度極限轉化為反應物時,相當于X2、Y2的起始濃度分別為0.2mol/L、0.4mol/L,而反應時轉化的量為1:1;
C.平衡時,不同物質的正逆反應速率之比等于化學計量數之比;
D.該反應可能為吸熱反應或放熱反應,若為放熱反應,升高溫度,平衡逆向移動.
解答 解:A.X2的起始濃度分別為0.1mol/L,若完全轉化生成Z為0.2mol,該反應為可逆反應,則Z的濃度小于0.4mol,可知平衡時Z的濃度可能為0.3mol/L,故A正確;
B.Z的濃度極限轉化為反應物時,相當于X2、Y2的起始濃度分別為0.2mol/L、0.4mol/L,而反應時轉化的量為1:1,可知轉化率一定不相等,故B錯誤;
C.平衡時,不同物質的正逆反應速率之比等于化學計量數之比,則平衡時,Y2和Z的生成速率之比為1:2,故C錯誤;
D.若為放熱反應,升高溫度,平衡逆向移動,則化學平衡常數減小,故D錯誤;
故選A.
點評 本題考查化學平衡的計算,為高頻考點,把握可逆反應的特點、轉化率計算、平衡判定、平衡常數與溫度的關系為解答的關鍵,側重分析與計算能力的考查,注意極限轉化法應用及選項D中焓變未知,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 乙酸的結構簡式 C2H4O2 | B. | 氯化鈉的電子式: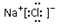 | ||
| C. | 硫原子的原子結構示意圖: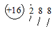 | D. | 水的電離方程式 2H2O═H3O++OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
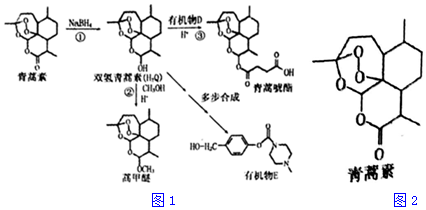
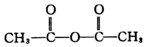 +H-OH→
+H-OH→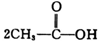
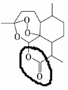 ;根據酯的性質判斷青蒿素可能具有的某種化學性質和反應條件為可在酸性或堿性條件下發生水解反應.屠呦呦教授率領的研究團隊先后經歷了用水、乙醇、乙醚提取青蒿素的探究過程,最終確認只有采用低溫、乙醚冷浸等方法才能成功提取青蒿素;研究發現這是因為青蒿素分子中的某個基團在提取過程中對熱不穩定,試寫出該基團的結構式-O-O-.
;根據酯的性質判斷青蒿素可能具有的某種化學性質和反應條件為可在酸性或堿性條件下發生水解反應.屠呦呦教授率領的研究團隊先后經歷了用水、乙醇、乙醚提取青蒿素的探究過程,最終確認只有采用低溫、乙醚冷浸等方法才能成功提取青蒿素;研究發現這是因為青蒿素分子中的某個基團在提取過程中對熱不穩定,試寫出該基團的結構式-O-O-.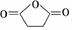 .
.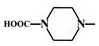 外,還需含苯環的二羥基化合物F,寫如有機物F與NaOH溶液反應的離子反應方程式
外,還需含苯環的二羥基化合物F,寫如有機物F與NaOH溶液反應的離子反應方程式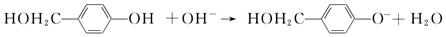 ,有機物G是F的同分異構體,有機物G遇FeCl3溶液顯紫色,且有4種不同類型的氫,其個數比為3:2:2:1,則符合條件的有機物G的同分異構體有3種.
,有機物G是F的同分異構體,有機物G遇FeCl3溶液顯紫色,且有4種不同類型的氫,其個數比為3:2:2:1,則符合條件的有機物G的同分異構體有3種.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | W、M的離子半徑為M<W | |
| B. | YZ2為直線形的共價化合物,W2Z2既含有離子鍵又含有共價鍵 | |
| C. | Z與X形成的化合物的熔沸點偏高是因其分子內存在氫鍵 | |
| D. | Z與M形成的化合物可作為耐高溫材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗及試劑 | 編號 | 無色NaClO3溶液用量 | 試管中溶液顏色 | 淀粉KI試紙顏色 |
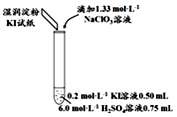 | 1 | 0.05mL | 淺黃色 | 無色 |
| 2 | 0.20mL | 深黃色 | 無色 | |
| 3 | 0.25mL | 淺黃色 | 藍色 | |
| 4 | 0.30mL | 無色 | 藍色 |
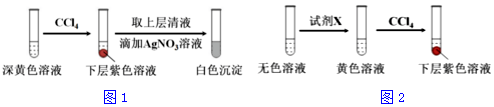
| 編號 | 6.0mol•L-1 H2SO4 溶液用量 | 試管中溶液顏色 | 淀粉KI試紙顏色 |
| 5 | 0.25mL | 淺黃色 | 無色 |
| 6 | 0.85mL | 無色 | 藍色 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 7.80g Na2O2與5.85g NaCl所含陰離子數相等 | |
| B. | 常溫常壓,16g氧氣與臭氧的混合物,氧原子為NA | |
| C. | 一定條件下,1.4g N2和0.2mol H2混合充分反應,轉移的電子數為0.3NA | |
| D. | 常溫下,2L pH=12的Na2CO3溶液中含有OH-數目為0.02NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na能與CuSO4溶液反應置換出紅色的銅 | |
| B. | Na2O是堿性氧化物,與酸反應生成鹽和水 | |
| C. | Na2O和Na2O2都能與水反應,生成物完全相同 | |
| D. | Na2O2是白色固體,可用于呼吸面具中氧氣的來源 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com